题目内容
(10分)用0.2000mol/L NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
(A)移取15.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准NaOH溶液润洗碱式滴定管2-3次
(C)把盛有标准溶液的滴定管固定好,使滴定管尖嘴充满溶液
(D)取标准溶液注入滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点,记下滴定管液面的刻度
完成以下各空:
(1)正确操作的顺序是B→_____→_____→_____→A→F;
(2)三次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 19.95 |
(3)用标准的NaOH溶液滴定未知浓度的盐酸,下列情况可能造成测定结果偏高的是: 。
A.配制标准溶液时称量的氢氧化钠固体中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
(1)D; C; E (2)0.2667 (3)AD
解析试题分析:(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,答案为:BDCEAF;(2)三次滴定消耗NaOH溶液的体积的平均值为(20.05+20.00+19.95)÷3=20.00mL,则该盐酸溶液的准确浓度为(0.200×20)÷15=0.2667mol/L。(3)A. 配制标准溶液时称量的氢氧化钠固体中混有Na2CO3杂质,导致标准液浓度降低,消耗体积增大,测定结果偏高;B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确,导致终点读数偏小,测定结果偏低,错误;C. 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗,无影响;错误D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,标准液体积增大,测定结果偏高,正确;选AD。
考点:考查酸碱中和滴定。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案19世纪初,某科学家提出了原子学说,他认为物质由原子组成,原子不能被创造,也不能被毁灭,在化学反应中不能再分,这个科学家是
| A.汤姆生 | B.道尔顿 | C.卢瑟福 | D.波尔 |
过程的自发性的作用是
| A.判断过程的方向 | B.确定过程是否一定会发生 |
| C.判断过程发生的速率 | D.判断过程的热效应 |
有一支50mL酸式滴定管其中盛有溶液,液面恰好在10mL刻度处,现把管内溶液全部流下排出,用量筒承接,该溶液的体积应为
| A.10mL | B.40mL | C.大于40mL | D.小于40ml |
常温下,将下列物质溶于水中分别配制成0.1 mol?L—1溶液,所得溶液pH大于7的是
| A.NaCl | B.HCl | C.NaOH | D.CH3COOH |
7分)实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。请完成下列填空:
取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验 编号 | NaOH溶液的浓度 (mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 22.50 | 20.00 |
| 2 | 0.10 | 25.80 | 20.00 |
| 3 | 0.10 | 22.62 | 20.00 |
(2)根据上述数据,可计算出该盐酸的浓度约为______________(保留两位有效数字)。
(3)排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______(填选项字母)。
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(11分)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:(1)选用的指示剂是 。
(2)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
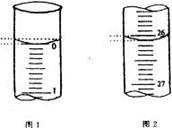
请将数据填入下面表格的空白处。
| 滴定次数 | 待测氢氧化钠溶液的体积/ mL | 0.1000 mol/L 盐酸的体积/ mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/ mL | ||
| 第一次 | 25.00 | | | |
| 第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(6)滴定终点的判定依据是 。
下列关于煤、石油、天然气等资源的说法正确的是
| A.石油裂解得到的汽油是纯净物 |
| B.石油产品都可用于聚合反应 |
| C.天然气是一种清洁的化石燃料 |
| D.水煤气是通过煤的液化得到的气体燃料 |
下列实验操作正确的是
| A.取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中。 |
| B.将含有Ba(NO3)2 的废液倒入水槽中,再用水冲入下水道。 |
| C.制取NaCl晶体时,将蒸发皿中NaCl溶液全部加热蒸干。 |
| D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,冷却至室温才能转移到容量瓶中。 |