题目内容
16.滴定实验是化学学科中重要的定量实验. 请回答下列问题:(1)酸碱中和滴定--用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是CD (填选项字母)
A、滴定终点读数时,俯视滴定管刻度,其他操作正确.
B、盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C、酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D、滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定--取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生的反应为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.表格中记录了实验数据:
| 滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
②该草酸溶液的物质的量浓度为0.2 mol•L-1.
(3)沉淀滴定--滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是D
(填选项字母).
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
分析 (1)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(2)①高锰酸钾溶液具有强氧化性,能够氧化碱式滴定管的橡胶管;根据滴定结束前溶液为无色,滴定结束时溶液变成紫红色到达滴定终点;
②先判断滴定数据的有效性,然后计算出消耗标准液的平均体积,再根据2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O计算出待测液的浓度;
(3)滴定结束时,继续滴加滴定剂,滴定剂和指示剂反应生成有明显颜色变化的沉淀,保证滴定剂和被滴定物完全反应.
解答 解:(1)A.滴定终点读数时,俯视滴定管刻度,其他操作正确,导致V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定结果偏低,故A错误;
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,此操作正确,不影响测定结果,故B错误;
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗,导致标准液浓度减小,导致V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定结果偏高,故C正确;
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失,导致V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定结果偏高,故D正确;
故选CD;
(2)①高锰酸钾溶液具有强氧化性,能够氧化碱式滴定管的橡胶管,所以应该使用酸式滴定管盛装高锰酸钾溶液;
滴定结束前混合液为无色,滴定结束时混合液变成了紫红色,所以滴定终点现象为:锥形瓶中溶液由无色变为紫红色,且半分钟内不褪色,
故答案为:酸;锥形瓶中溶液由无色变为紫红色,且半分钟内不褪色;
②三次滴定消耗标准液体积分别为:19.90mL,20.00mL,20.10mL,三次滴定的数据都有效,消耗标准液的平均体积为:$\frac{19.90mL+20.00mL+20.10mL}{2}$=20.00mL,高锰酸钾的物质的量为0.1mol•L-1×0.020L=0.002mol,根据反应2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O可知,n(H2C2O4)=$\frac{5}{2}$n(KMnO4)=0.005mol,待测液草酸的物质的量浓度c(H2C2O4)=$\frac{0.005mol}{0.025L}$=0.2 mol•L-1;
故答案为:0.2 mol•L-1;
(3)若用AgNO3去滴定NaSCN溶液,可选用的滴定指示剂的物质的溶解度应比AgSCN大,且现象明显,应为Na2CrO4,混合物中有砖红色沉淀生成,
故答案为:D.
点评 本题考查了中和滴定操作,涉及中和滴定、氧化还原滴定、沉淀滴定,掌握反应原理是解题的关键,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力.

 轻松课堂标准练系列答案
轻松课堂标准练系列答案| A. | HNO3和NH4NO3 | B. | NaOH和KCl | C. | NaN3和CaO2 | D. | AlCl3和MgCl2 |
用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | / |
| Ⅱ | 2mL | 30 | / |
| Ⅲ | 1mL | 20 | 1mL蒸馏水 |
| Ⅳ | A | 20 | B |
(2)如果研究温度对化学反应速率的影响,使用实验Ⅰ、Ⅱ (用Ⅰ~Ⅳ表示,下同).
(3)对比实验Ⅰ和Ⅲ,可以研究浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保溶液总体积不变.
(4)在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速度加快.从影响化学反应速率的因素看,你猜想反应速率明显加快的原因还可能是催化剂(或锰离子的催化作用)的影响.
A.2mL B.硫酸锰.
 草酸(H2C2O4)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5,具有还原性,溶于水,溶液有酸性,为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
草酸(H2C2O4)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5,具有还原性,溶于水,溶液有酸性,为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O(1)滴定管在使用之前,必须进行的操作是检查是否漏水,滴定时,KMnO4溶液应装在酸式滴定管(填“酸式滴定管”或“碱式滴定管”)中,达到滴定终点时的现象为滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色.
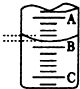
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,C处的刻度为20,滴定管中液面读数应为19.40mL,此时滴定管中液体的体积大于30.60mL.(填大于、小于或等于)
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 22.32 | 24.39 | 24.41 |
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过后,未用标准液润洗.
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出H2C2O4的物质的量浓度的表达式(必须化简):C=$\frac{61c}{V}$mol/L.
(5)请你一个设计简单实验证明草酸的酸性强于碳酸,实验操作及现象是取少量的NaHCO3于试管中,加入草酸溶液,有气泡产生.
| A. | 少量二氧化碳通入“水玻璃”中:C02+SiO32-+H20═C032-+H2SiO3↓ | |
| B. | 氨水滴入 AlCl3 溶液中:Al3++30H-═Al(0H)3↓ | |
| C. | 铝溶解在NaOH溶液中:2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑ | |
| D. | Al2O3溶于 NaOH 溶液中:Al2O3+2OH-+3H2O=2[Al(0H)4]- |
| A. | 若HnXOm为强酸,则X的氢化物溶于水一定显酸性 | |
| B. | 若X(OH)n为强碱,则Y(OH)n也一定为强碱 | |
| C. | 若X元素形成的单质是X2,则Y元素形成的单质也一定是Y2 | |
| D. | 若Y的最高正化合价为+m,则X的最高正化合价一定为+m |
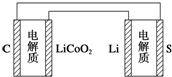 已知:锂离子电池的总反应为LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )
已知:锂离子电池的总反应为LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )| A. | 锂离子电池放电时,Li+向负极迁移 | |
| B. | 锂硫电池充电时,锂电极发生氧化反应 | |
| C. | 理论上两种电池的比能量相同 | |
| D. | 下图表示用锂硫电池给锂离子电池充电 |
 .
.