题目内容
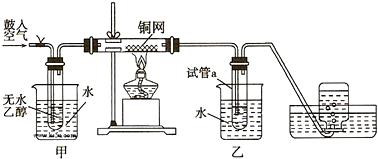
18.利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如图:
根据要求填空:
(1)A装置中发生反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O
(2)B装置有三种功能:①控制气流速度;②均匀混合气体;③干燥混合气体
(3)设V(Cl2)/V(CH4)=x,理论上欲获得最多的氯化氢,则X≥4
(4)D装置的石棉中均匀混有KI粉末,其作用是吸收过量的氯气
(5)写出C装置中生成一氯甲烷的化学反应方程式CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl
(6)E装置中除盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为A
A、分液法 B、蒸馏法 C、萃取分液法 D、结晶法
(7)该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为AB
A、CH4 B、CH3Cl C、CH2Cl2 D、CHCl3.
分析 (1)装置A中浓盐酸与二氧化锰加热反应生成氯化锰、氯气和水,据此写出反应的化学方程式;
(2)浓硫酸可以干燥氯气和氯化氢;
(3)1mol氯气可取代1molH原子生成1molHCl,欲获得最多的氯化氢,则甲烷中的H原子被完全取代;
(4)氯气能将碘化钾氧化为碘单质;
(5)甲烷与氯气在光照条件下发生取代反应生成一氯甲烷和氯化氢;
(6)最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离;
(7)尾气中含有一氯甲烷,还可能有过量的甲烷.
解答 解:实验室用浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,Cl2经干燥后和甲烷在光照条件下发生取代反应,生成多种氯代烃和HCl,在强光照射下可发生CH4+2Cl2 $\stackrel{光照}{→}$C+4HCl,生成的黑色小颗粒为炭黑,最后生成的HCl溶于水生成盐酸,
(1)A中浓盐酸与二氧化锰在加热条件下反应生成氯气,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Cl2↑+MnCl2+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Cl2↑+MnCl2+2H2O;
(2)生成的氯气中含有水,B装置除具有控制气流速度、均匀混合气体之外,因浓硫酸具有吸水性,还具有干燥作用,
故答案为:干燥混合气体;
(3)氯气与甲烷发生取代反应,反应特点是1mol氯气可取代1molH原子生成1molHCl,设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应保证甲烷被完全取代,x应大于或等于4,
故答案为:≥4;
(4)氯气具有氧化性,KI中-1价的碘能被氯气氧化,产物为氯化钾固体和碘单质,所以,D装置的石棉中均匀混有KI粉末,能吸收过量的氯气,
故答案为:吸收过量的氯气;
(5)甲烷与氯气反应生成一氯甲烷的方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,
故答案为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;
(6)烷可以和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳,其中一氯甲烷为气态,反应生成的二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液分开,
故答案为:A;
(7)一氯甲烷是气体,还可能有过量的甲烷,所以尾气的主要成分是可能存在剩余的甲烷和生成的一氯甲烷等气体,应进行尾气处理,
故答案为:AB.
点评 本题考查了物质性质实验的设计,主要考查了氯气的制备以及甲烷与氯气的取代反应,题目难度中等,注意掌握性质实验方案的设计与评价原则,试题侧重于考查学生的实验探究能力和对基础知识的综合应用能力.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 福尔马林 | B. | 甲醇 | C. | 溴乙烷 | D. | 氯乙烯 |
| A. | 己烷 | B. | 乙烯 | C. | 苯 | D. | 乙醇 |
 已知某可逆反应:2M(g)?N(g)△H<0.现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示.下列说法中,正确的是( )
已知某可逆反应:2M(g)?N(g)△H<0.现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示.下列说法中,正确的是( )| A. | a、b、c、d四个点中处于平衡状态的点是a、b | |
| B. | 反应进行至25 min时,曲线发生变化的原因是加入了0.4 mol N | |
| C. | 若调节温度使35 min时体系内N的体积分数与15 min时相等,应升高温度 | |
| D. | 若在40 min时出现如图所示变化,则可能是因为加入催化剂引起的 |
| A. | 由同种元素组成的纯净物叫单质 | |
| B. | 由两种或两种以上的元素组成的物质叫混合物 | |
| C. | 石油是一种纯净物 | |
| D. | 合金都是化合物 |
| A. | 2A ( l )+B ( l )=2C (g )△H1 | B. | 2A ( g )+B ( g )=2C (g )△H2 | ||
| C. | 2A ( g )+B ( g )=2C ( l )△H3 | D. | 2A ( l )+B ( l )=2C ( l )△H4 |
 .
.