题目内容
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象发如下表:
实验方案 | 实验现象 |
1.用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 2.向新制的H2S饱和溶液中滴加新制的氯水 3.钠与滴有酚酞试液的冷水反应 4.镁带与2mol/L的盐酸反应 5.铝条与2mol/L的盐酸反应 6.向AlCl3溶液中滴加NaOH溶液至过量 | A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生大量气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成白色絮状沉淀,继而沉淀消失 F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的:
(2)实验用品:仪器、材料 略 药品 略
(3)实验内容:(填写题给信息表中的序号或大写英文字母,并写出有空格处的离子
方程式)
实验方案 | 实验现象 | 有关离子方程式 |
| A |
|
| B | 不 填 |
|
| 不 填 |
|
| 不 填 |
| E |
|
| F |
|
(4)实验结论: 。
(5)问题与讨论:
① 请从原子结构理论上简单说明具有上述结论的原因 。
② 请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
(1)同周期元素金属性,非金属性性质逆变规律。(验证Na、Mg、Al金属性强弱及S、Cl非金属性强弱,证明第三周期元素的递变规律。)(2分)
(3)(实验方案2分;每个方程式1分)
实验方案 | 实验现象 | 有关离子方程式 |
3 | A | 2Na+2H2O=2Na++2OH-+H2↑ |
1 | B |
|
4 |
|
|
5 |
|
|
6 | E | Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O |
2 | F | H2S+Cl2=2H++2Cl-+S↓ |
(4)同周期元素随原子序数的增大,元素的金属性逐渐减弱,而非金属逐渐增强。(2分)
(5)① 同周期元素,随原子数增加,r在减小,原子核内的质子数也在增加,原子核对于核外电子的束缚能力渐强,原子的失e-能力减弱,而得e-能力逐渐增强。(2分)

 名校课堂系列答案
名校课堂系列答案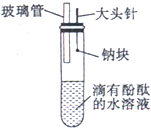 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表.
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表.