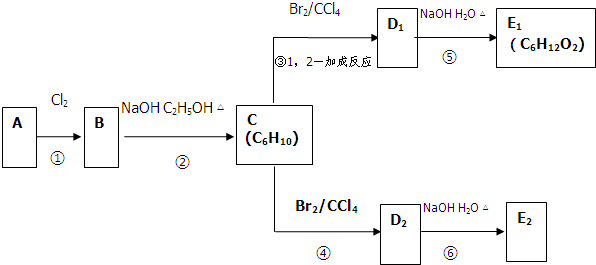
题目内容
过碳酸钠(Na2CO3?3H2O2),有固体双氧水的俗称,该晶体具有Na2CO3和H2O2的双重性质,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,过碳酸钠的某生产流程如图1所示.
已知:2Na2CO3+2H2O2=2Na2CO3?3H2O2△H<0;回答下列问题:
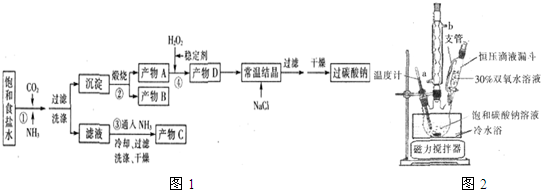
(1)下列物质可使过碳酸钠较快失效的是(填序号) .
A.FeCl3溶液 B.H2S C.稀硫酸 D.NaHCO3溶液
(2)反应①应先通入的气体是 .
(3)在上述流程中,向反应前的H2O2中加入稳定剂的作用是 .
(4)该生产流程中可循环使用的物质是 (填化学式).
(5)生产过碳酸钠的流程中遗漏了一步,造成所得产品纯度偏低,请简述该步操作过程 .
(6)实验室利用图2装置制备过碳酸钠,该装置中恒压滴液漏斗中支管的作用是 ,冷凝管应从 处进水.
(7)由实验测定反应温度对产物的影响如下表:根据下表数据,你认为反应最佳的温度选择的范围是 .
已知:2Na2CO3+2H2O2=2Na2CO3?3H2O2△H<0;回答下列问题:

(1)下列物质可使过碳酸钠较快失效的是(填序号)
A.FeCl3溶液 B.H2S C.稀硫酸 D.NaHCO3溶液
(2)反应①应先通入的气体是
(3)在上述流程中,向反应前的H2O2中加入稳定剂的作用是
(4)该生产流程中可循环使用的物质是
(5)生产过碳酸钠的流程中遗漏了一步,造成所得产品纯度偏低,请简述该步操作过程
(6)实验室利用图2装置制备过碳酸钠,该装置中恒压滴液漏斗中支管的作用是
(7)由实验测定反应温度对产物的影响如下表:根据下表数据,你认为反应最佳的温度选择的范围是
| T/℃ | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:氨气易溶于水,与二氧化碳、氯化钠反应生成碳酸氢钠和氯化铵,碳酸氢钠分解生成碳酸钠(A)、水和二氧化碳,碳酸钠与双氧水反应生成过碳酸钠.
(1)过碳酸钠(Na2CO3?3H2O2)具有Na2CO3和H2O2的双重性质;
(2)二氧化碳在水中的溶解度很小,而氨气极易溶于水;
(3)双氧水稳定性差,易分解;
(4)碳酸氢钠分解生成碳酸钠、水和二氧化碳;
(5)从溶液中过滤出固体后,需要洗涤沉淀;
(6)恒压滴液漏斗能保持压强恒定;
(7)根据表数据可知温度超过20℃后,活性氧百分含量和产率均降低.
(1)过碳酸钠(Na2CO3?3H2O2)具有Na2CO3和H2O2的双重性质;
(2)二氧化碳在水中的溶解度很小,而氨气极易溶于水;
(3)双氧水稳定性差,易分解;
(4)碳酸氢钠分解生成碳酸钠、水和二氧化碳;
(5)从溶液中过滤出固体后,需要洗涤沉淀;
(6)恒压滴液漏斗能保持压强恒定;
(7)根据表数据可知温度超过20℃后,活性氧百分含量和产率均降低.
解答:
解:(1)A.FeCl3溶液能与碳酸钠反应,因此氯化铁也与过碳酸钠反应,故A正确;
B.H2S与双氧水发生氧化还原反应,则也与过碳酸钠发生氧化还原反应,故B正确;
C.稀硫酸与碳酸钠反应,因此也与过碳酸钠反应,故C正确;
D.NaHCO3溶液与碳酸钠以及双氧水等均不反应,因此也与过碳酸钠不反应,故D错误.
故答案为:ABC;
(2)二氧化碳在水中的溶解度很小,而氨气极易溶于水,所以反应①应先通入的气体是氨气,故答案为:NH3;
(3)由于双氧水稳定性差,易分解,因此向反应前的H2O2中加入稳定剂的作用是防止双氧水分解,故答案为:防止双氧水分解;
(4)碳酸氢钠分解生成碳酸钠、水和二氧化碳,即A是碳酸钠,B是二氧化碳,因此该生产流程中可循环使用的物质是CO2,故答案为:CO2;
(5)从溶液中过滤出固体后,需要洗涤沉淀,因此该步操作是沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作数次,故答案为:沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作数次;
(6)恒压滴液漏斗能保持压强恒定,因此恒压滴液漏斗中支管的作用是使液体顺利流下.冷凝管应从下端进水,即a处进水上端出水,故答案为:使液体顺利流下;a;
(7)根据表数据可知温度超过20℃后,活性氧百分含量和产率均降低,所以反应最佳的温度选择的范围是15~20℃,故答案为:5~20℃.
B.H2S与双氧水发生氧化还原反应,则也与过碳酸钠发生氧化还原反应,故B正确;
C.稀硫酸与碳酸钠反应,因此也与过碳酸钠反应,故C正确;
D.NaHCO3溶液与碳酸钠以及双氧水等均不反应,因此也与过碳酸钠不反应,故D错误.
故答案为:ABC;
(2)二氧化碳在水中的溶解度很小,而氨气极易溶于水,所以反应①应先通入的气体是氨气,故答案为:NH3;
(3)由于双氧水稳定性差,易分解,因此向反应前的H2O2中加入稳定剂的作用是防止双氧水分解,故答案为:防止双氧水分解;
(4)碳酸氢钠分解生成碳酸钠、水和二氧化碳,即A是碳酸钠,B是二氧化碳,因此该生产流程中可循环使用的物质是CO2,故答案为:CO2;
(5)从溶液中过滤出固体后,需要洗涤沉淀,因此该步操作是沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作数次,故答案为:沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作数次;
(6)恒压滴液漏斗能保持压强恒定,因此恒压滴液漏斗中支管的作用是使液体顺利流下.冷凝管应从下端进水,即a处进水上端出水,故答案为:使液体顺利流下;a;
(7)根据表数据可知温度超过20℃后,活性氧百分含量和产率均降低,所以反应最佳的温度选择的范围是15~20℃,故答案为:5~20℃.
点评:本题考查了固体双氧水过碳酸钠(2Na2CO3?3H2O2)的制取方法及其性质,涉及内容较多,充分考查了学生的综合能力,本题难度稍大.

练习册系列答案
相关题目
对于反应中的能量变化,表述正确的是( )
| A、物质发生化学反应时一定都伴随着能量变化 |
| B、断开化学键的过程会放出能量 |
| C、加热才能发生的反应一定是吸热反应 |
| D、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;Z2-离子半径大于W-离子半径;Y是一种重要的半导体材料.下列说法中错误的是( )
| A、元素X、M可形成既含离子键又含共价键的化合物 |
| B、气态氢化物的稳定性:Z<W |
| C、Y元素在自然界中以化合物的形式存在 |
| D、W元素的含氧酸都属于强酸 |
氯化铁溶液和氢氧化铁胶体共同具有的性质是( )
| A、分散质微粒都能透过滤纸 |
| B、都有丁达尔现象 |
| C、加入盐酸后,都先产生沉淀,然后沉淀又溶解 |
| D、都有电泳现象 |
 ;
; .
.