题目内容
 人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:【配制KMnO4标准溶液】如图是配制50mLKMnO4标准溶液的过程示意图.
(1)上述过程中有两处错误,请你观察图示判断其中不正确的操作是(填序号)
(2)其中确定50mL溶液体积的容器是(填名称)
【测定血液样品中Ca2+的浓度】抽取血样20.00mL,经过上述处理后得到草酸,再用硫酸酸化的0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液.
(3)滴定时,盛放高锰酸钾溶液的仪器名称为
(4)草酸跟酸性KMnO4溶液反应的离子方程式为:
(5)根据所给数据计算血液样品中Ca2+离子的浓度为
考点:溶液的配制,中和滴定
专题:实验题
分析:(1)根据配制一定物质的量浓度的溶液的正确操作结合图示分析解答;
(2)依据容量瓶的用途解答;依据仰视刻度线,会使溶液体积偏大判断,结合C=
分析;
(3)碱式滴定管能够量取碱性和非氧化性液体,酸性滴定管可以量取酸性和氧化性液体;草酸具有还原性,能够使高锰酸钾褪色;
(4)草酸跟酸性KMnO4溶液反应生成二氧化碳、二价锰离子等,结合氧化还原反应得失电子守恒写出化学方程式;
(5)根据滴定数据及钙离子与高锰酸钾的关系式计算出血液样品中Ca2+的浓度.
(2)依据容量瓶的用途解答;依据仰视刻度线,会使溶液体积偏大判断,结合C=
| n |
| V |
(3)碱式滴定管能够量取碱性和非氧化性液体,酸性滴定管可以量取酸性和氧化性液体;草酸具有还原性,能够使高锰酸钾褪色;
(4)草酸跟酸性KMnO4溶液反应生成二氧化碳、二价锰离子等,结合氧化还原反应得失电子守恒写出化学方程式;
(5)根据滴定数据及钙离子与高锰酸钾的关系式计算出血液样品中Ca2+的浓度.
解答:
解:(1)量筒为精密仪器,不能在量筒中溶解固体,故②错误,定容时应平视刻度线,至溶液凹液面与刻度线相切,⑤错误;
故选:②⑤;
(2)容量瓶是专门用来配制一定浓度溶液的精密仪器;如果用图示的操作配制溶液,由于仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小;
故答案为:容量瓶;偏小;
(3)酸性高锰酸钾具有强的氧化性,应盛放在酸式滴定管内;草酸具有还原性,能够使高锰酸钾褪色,向无色草酸中加入酸性高锰酸钾,当草酸反应完后,滴加高锰酸钾显紫红色,滴定到达终点;
故答案为:酸式滴定管;溶液由无色变为紫红色;
(4)草酸跟酸性KMnO4溶液反应,离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O;
故答案为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O;
(5)血样20.00mL经过上述处理后得到草酸,草酸消耗的消耗的高锰酸钾的物质的量为:0.020mol/L×0.012L=2.4×10-4mol,根据反应方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,及草酸钙的化学式CaC2O4,可知:n(Ca2+)=n(H2C2O4)=
n(MnO4-)=2.5×2.4×10-4mol=6×10-4mol,
Ca2+的质量为:40g/mol×6×10-4mol=0.024g,钙离子的浓度为:
=0.0012g/cm3=1.2 mg/cm3,
故答案为:1.2.
故选:②⑤;
(2)容量瓶是专门用来配制一定浓度溶液的精密仪器;如果用图示的操作配制溶液,由于仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小;
故答案为:容量瓶;偏小;
(3)酸性高锰酸钾具有强的氧化性,应盛放在酸式滴定管内;草酸具有还原性,能够使高锰酸钾褪色,向无色草酸中加入酸性高锰酸钾,当草酸反应完后,滴加高锰酸钾显紫红色,滴定到达终点;
故答案为:酸式滴定管;溶液由无色变为紫红色;
(4)草酸跟酸性KMnO4溶液反应,离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O;
故答案为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O;
(5)血样20.00mL经过上述处理后得到草酸,草酸消耗的消耗的高锰酸钾的物质的量为:0.020mol/L×0.012L=2.4×10-4mol,根据反应方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,及草酸钙的化学式CaC2O4,可知:n(Ca2+)=n(H2C2O4)=
| 5 |
| 2 |
Ca2+的质量为:40g/mol×6×10-4mol=0.024g,钙离子的浓度为:
| 0.024g |
| 20cm3 |
故答案为:1.2.
点评:本题考查了配制一定物质的量浓度的方法及误差分析,氧化还原滴定,明确配置一定物质的量浓度原理和操作步骤、明确氧化还原滴定原理和操作是解题关键,侧重考查学生对实验基本知识的掌握情况,题目难度中等.

练习册系列答案
相关题目
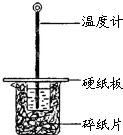 某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法不正确的是( )
某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法不正确的是( )| A、该实验也可在保温杯中进行 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎纸条的作用是保温、隔热,减少热量损失 |
| D、若将盐酸体积改为60 mL,两次实验所求得中和热不相等 |
常温下,有甲、乙两份体积为1L、浓度均为0.1mol.?L-1的醋酸溶液,其pH为3,①甲用蒸馏水稀释100倍后,溶液的pH变为x; ②乙与等体积、浓度为0.2mol?L-1的NaOH混合,在混合液中:n(CH3COO-)+n(OH-)-n(H+)=y mol.x、y的正确答案组合为( )
| A、3;0.1 |
| B、5;0.2 |
| C、3<x<5;0.1 |
| D、3<x<5;0.2 |
近来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全.电池总反应式为C2H5OH+3O2═2CO2+3H2O,下列说法不正确的是( )
| A、C2H5OH在电池的负极上发生氧化反应 |
| B、1mol乙醇被氧化转移6 mol电子 |
| C、在外电路中电子由负极沿导线流向正极 |
| D、电池正极的电极反应为4H++O2+4e-═2H2O |
下列离子在溶液中能大量共存的是( )
| A、Na+、CO32-、SO42-、H+ |
| B、K+、OH-、H+、Cl- |
| C、Mg2+、H+、NO3-、SO42- |
| D、Fe3+、K+、OH-、NO3- |
下列说法正确的是( )
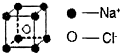

| A、1mol白磷晶体中含有的P-P键的个数为4NA |
| B、12g金刚石中含有的C-C键的个数为1.5NA |
| C、12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| D、1mol氯化钠(晶胞如图)中含有Na+数目为8NA |