题目内容
KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其变化可表示为: KClO3+ HCl(浓)→ KCl+ ClO2↑+ Cl2↑+ H2O
(1)请完成该化学方程式并配平,并标出电子转移的方向和数目.
(2)浓盐酸在反应中显示出来的性质是 (填写序号).
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1mol Cl2,则转移的电子的物质的量为 mol.
(1)请完成该化学方程式并配平,并标出电子转移的方向和数目.
(2)浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1mol Cl2,则转移的电子的物质的量为
考点:氧化还原反应方程式的配平,氧化还原反应的电子转移数目计算
专题:氧化还原反应专题
分析:(1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;再结合元素守恒,配平各物质的系数.
(2)根据HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各占一半.
(3)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,据此计算转移电子物质的量.
(2)根据HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各占一半.
(3)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,据此计算转移电子物质的量.
解答:
解:(1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;所以KClO3系数为2,KCl系数为2,HCl系数为4,水的系数是2.电子转移的方向和数目为: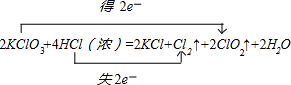
故答案为:2;4;2;1;2;2;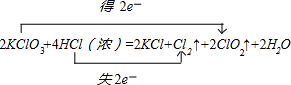 ;
;
(2)反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各占一半.
故选:②;
(3)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2,转移的电子的物质的量为0.1mol×2=0.2mol.
故答案为:0.2.
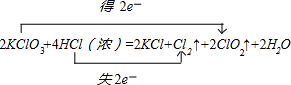
故答案为:2;4;2;1;2;2;
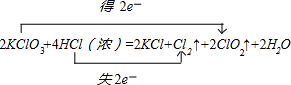 ;
;(2)反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各占一半.
故选:②;
(3)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2,转移的电子的物质的量为0.1mol×2=0.2mol.
故答案为:0.2.
点评:本题考查氧化还原反应基本概念、配平、计算等,难度中等,判断氧化产物、还原产物是关键,注意同种元素反应氧化还原反应价态归中不交叉原则.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图Ⅰ所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图Ⅱ所示.
可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图Ⅰ所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图Ⅱ所示. ①a1=a2
②a1<a2
③b1=b2
④b1<b2
⑤t1>t2 ⑥t1=t2
⑦两图中阴影部分面积相等
⑧图Ⅱ中阴影部分面积更大
以上所列正确的为( )
| A、②④⑤⑦ | B、②④⑤⑧ |
| C、②③⑤⑦ | D、②③⑤⑧ |
有Y、Z、W、M四种短周期元素,其中Y、Z、W同周期,Z、M同主族;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法中,正确的是( )
| A、YM2晶体中Y原子为sp3杂化 |
| B、由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
| C、Z、M形成的两种分子都是极性分子 |
| D、WM3-的空间构型为平面三角形 |
短周期主族元素A、B、C、D、E的原子序数依次增大,其中只有C是金属元素,B是地壳中含量最多的元素,A元素常见化合价为+1和-1;A与C的最外层电子数相同,C、D两元素原子的电子数之和为A、B两种元素原子的电子数之和的3倍.下列叙述正确的是( )
| A、元素的原子半径:A<B<C<D<E |
| B、对应氢化物的热稳定性:D>E |
| C、B与C、B与D形成的化合物中化学键类型相同 |
| D、五种元素中最高价氧化物对应的水化物酸性最强的是E. |
设阿伏加德罗常数为NA,下列说法正确的是( )
| A、1 mol Cl2与足量Fe反应,转移的电子数为3NA |
| B、常温常压下,14g氮气中含有 NA个原子 |
| C、1 mol的NO2和N2O4混合气体中含有的原子数为3NA |
| D、在25℃、101 kPa时,22.4 L氢气中含有NA个氢分子 |

 北京奥运会火炬使用的燃料为丙烷(C3H8),它是一种价格低廉的常用燃料,丙烷是由碳和氢两种元素组成,燃烧后只有二氧化碳和水,不会对环境造成污染.已知1g丙烷完全燃烧放出50.452kJ热量.试回答下列问题:
北京奥运会火炬使用的燃料为丙烷(C3H8),它是一种价格低廉的常用燃料,丙烷是由碳和氢两种元素组成,燃烧后只有二氧化碳和水,不会对环境造成污染.已知1g丙烷完全燃烧放出50.452kJ热量.试回答下列问题: