题目内容
4.下列物质的熔沸点高低顺序中,正确的是( )| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | H2Te>H2Se>H2S>H2O | ||
| C. | MgO>NaCl>H2O>HF | D. | 金刚石>生铁>纯铁>钠 |
分析 A.原子晶体中共价键的键长越短,键能越大,熔、沸点越大;
B.水分子间存在氢键;
C.MgO和NaCl都是离子晶体,镁的电荷数大于钠,镁离子的半径小于钠离子,所以氧化镁的晶格能大于氯化钠;水和氟化氢都是含有氢键的分子晶体,而水分子之间氢键数目多,所以水的熔沸点氟化氢;
D.熔、沸点:原子晶体>金属晶体,合金的熔点比纯金属的低.
解答 解:A.原子晶体中共价键的键长越短,键能越大,熔、沸点越大,则熔、沸点为金刚石>二氧化硅>碳化硅>晶体硅,故A错误;
B.水分子间存在氢键,所以熔沸点高低顺序是H2O>H2Te>H2Se>H2S,故B错误;
C.MgO和NaCl都是离子晶体,镁的电荷数大于钠,镁离子的半径小于钠离子,所以氧化镁的晶格能大于氯化钠;水和氟化氢都是含有氢键的分子晶体,而水分子之间氢键数目多,所以水的熔沸点氟化氢,所以熔沸点高低顺序:MgO>NaCl>H2O>HF,故C正确;
D.熔、沸点:原子晶体>金属晶体,合金的熔点比纯金属的低,则熔、沸点为金刚石>纯铁>生铁>钠,故D错误;
故选C.
点评 本题考查元素周期律,侧重考查学生分析推断能力,知道晶体熔沸点高低判断方法,比较容易.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
14.25℃时,浓度为0.1mol/L的某一元强碱MOH溶液与相同体积的某一元酸HA溶液混合后恰好呈中性.下列判断一定正确的是( )
| A. | HA酸溶液的pH值一定等于1 | |
| B. | HA酸溶液的物质的量浓度一定等于0.1mol/L | |
| C. | 中和后溶液中M+离子浓度一定等于A-离子浓度 | |
| D. | 中和后生成的盐MA一定没有发生水解 |
12.已知下列几个反应的化学方程式:①2KI+Cl2═2KCl+I2、②2FeCl2+Cl2═2FeCl3、③2FeCl3+2HI═2FeCl2+I2+2HCl,下列有关物质的氧化性的强弱排列顺序中正确的是( )
| A. | Cl2>Fe3+>I2 | B. | Cl2>I2>Fe3+ | C. | Fe3+>Cl2>I2 | D. | Fe3+>I2>Cl2 |
9.取Fe、FeO、Fe2O3的均匀混合物质量为6.4g,向其中加入200mL 1mol•L-1的盐酸,恰好使混合物完全溶解,放出1120mL(标准状况)的气体.所得溶液中,加入KSCN溶液无血红色出现,那么若用足量的CO在高温下还原相同质量的此混合物,并将产生的CO通入过量澄清石灰水中,生成沉淀的质量为( )
| A. | 2.5g | B. | 5.0g | C. | 7.5g | D. | 10.0g |
13.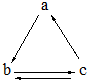 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
( )
 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | CO2 | Na2CO3 | NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |



