题目内容
硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(如图).下列说法正确的是( )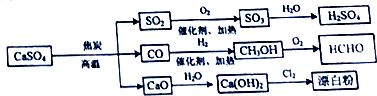

| A、漂白粉的主要成分为Ca(ClO)2 |
| B、蔗糖中加入浓硫酸,搅拌后产生大量的CO2、SO2、SO3 |
| C、SO2、CH3OH、HCHO 都能使酸性高锰酸溶液褪色 |
| D、CaO 是碱性氧化物,CO、SO2、SO3都是酸性氧化物 |
考点:氯、溴、碘及其化合物的综合应用,酸、碱、盐、氧化物的概念及其相互联系,二氧化硫的化学性质,浓硫酸的性质
专题:
分析:A.漂白粉的主要成分为氯化钙和次氯酸钙;
B.浓硫酸被还原生成二氧化硫气体;
C.SO2、CH3OH、HCHO 都具有还原性;
D.CO与碱不反应.
B.浓硫酸被还原生成二氧化硫气体;
C.SO2、CH3OH、HCHO 都具有还原性;
D.CO与碱不反应.
解答:
解:A.漂白粉的主要成分为氯化钙和次氯酸钙,有效成分为次氯酸钙,故A错误;
B.浓硫酸被还原生成二氧化硫气体,没有三氧化硫,故B错误;
C.SO2、CH3OH、HCHO 都具有还原性,可使酸性高锰酸钾发生氧化还原反应,故C正确;
D.CO与碱不反应,为不成盐氧化物,故D错误.
故选C.
B.浓硫酸被还原生成二氧化硫气体,没有三氧化硫,故B错误;
C.SO2、CH3OH、HCHO 都具有还原性,可使酸性高锰酸钾发生氧化还原反应,故C正确;
D.CO与碱不反应,为不成盐氧化物,故D错误.
故选C.
点评:本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力的考查,注意把握相关物质的性质,难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、Al在氧气中燃烧时发出耀眼的白光,可用于制造信号弹 |
| B、铜的金属活动性比铝弱,可用铜罐代替铝罐储运浓硝酸 |
| C、明矾可用于除去酸性废水中的悬浮颗粒 |
| D、用高纯度的二氧化硅制作的光导纤维遇强碱会“断路” |
下列说法正确的是( )
| A、工业制漂白粉是将氯气通入石灰水中制备 |
| B、海水中提取溴的方法是在经处理得到的含溴单质的水中鼓入热空气或水蒸气使溴单质挥发出来 |
| C、硫粉在过量的纯氧中燃烧可以生成三氧化硫 |
| D、少量二氧化碳通入氯化钙溶液中能生成白色沉淀 |
短周期元素X、Y的单质分别为M、N,在水溶液中发生置换反应:M+化合物(Ⅰ)=N+化合物(Ⅱ)(反应条件省略),下列推断不正确的是( )
| A、若X为金属,Y为非金属,则X和Y可能位于周期表中不同主族 |
| B、若X为非金属,Y为非金属,则X和Y一定位于周期表中同一主族 |
| C、若M、N在常温下呈气态,则X、Y不可能位于同一主族 |
| D、若在常温下,M为气态,N为固态,则X、Y可能位于同一周期 |
电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去.下列说法不正确的是( )
A、电路中每转移12 mol电子,最多有 2 mol Cr2O
| ||
| B、阳极反应为Fe-2e-═Fe2+ | ||
| C、电解过程中溶液pH增大 | ||
| D、电解过程中有Fe(OH)3沉淀生成 |
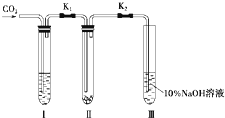 为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,某课题研究小组的同学们设计了如图的实验装置,分别进行了甲、乙两次实验:
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,某课题研究小组的同学们设计了如图的实验装置,分别进行了甲、乙两次实验: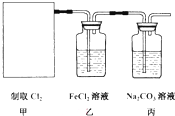
 A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验: