题目内容
电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去.下列说法不正确的是( )
A、电路中每转移12 mol电子,最多有 2 mol Cr2O
| ||
| B、阳极反应为Fe-2e-═Fe2+ | ||
| C、电解过程中溶液pH增大 | ||
| D、电解过程中有Fe(OH)3沉淀生成 |
考点:电解原理
专题:
分析:A.Fe-2e-=Fe2+,则转移电子数12mol需要6molFe,再根据能够处理的关系式,得6Fe~12e-~6Fe2+~Cr2O72-,据此计算;
B.Fe板作阳极,为活性电极,Fe失电子,发生氧化反应生成亚铁离子;
C.由反应式Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,处理过程中消耗氢离子
D.阴极发生还原反应,溶液中的氢离子得到电子减少,同时生成氢氧根.
B.Fe板作阳极,为活性电极,Fe失电子,发生氧化反应生成亚铁离子;
C.由反应式Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,处理过程中消耗氢离子
D.阴极发生还原反应,溶液中的氢离子得到电子减少,同时生成氢氧根.
解答:
解:A.Fe-2e-=Fe2+,则转移电子数12mol需要6molFe,再根据能够处理的关系式,得6Fe~12e-~6Fe2+~Cr2O72-,故被还原的Cr2O72-的物质的量为1mol,故A错误;
B.Fe板作阳极,为活性电极,Fe失电子,发生氧化反应生成亚铁离子,阳极反应为Fe-2e-═Fe2+,故B正确;
C.由反应式Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,处理过程中消耗氢离子,溶液的酸性减弱,溶液pH增大,故C正确;
D.阴极发生还原反应,溶液中的氢离子得到电子减少,同时生成氢氧根,有Fe(OH)3沉淀生成,故D正确;
故选A.
B.Fe板作阳极,为活性电极,Fe失电子,发生氧化反应生成亚铁离子,阳极反应为Fe-2e-═Fe2+,故B正确;
C.由反应式Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,处理过程中消耗氢离子,溶液的酸性减弱,溶液pH增大,故C正确;
D.阴极发生还原反应,溶液中的氢离子得到电子减少,同时生成氢氧根,有Fe(OH)3沉淀生成,故D正确;
故选A.
点评:本题考查电解原理、氧化还原反应等,清楚发生的电极反应是解题的关键,是对学生综合能力的考查,难度中等.

练习册系列答案
相关题目
利用如图实验装置能完成相应实验的是( )
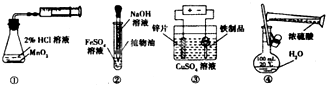

| A、装置①测定化学反应速率 |
| B、装置②制取少量的氢氧化亚铁 |
| C、装置③铁制品表面镀锌 |
| D、装置④稀释浓硫酸 |
硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(如图).下列说法正确的是( )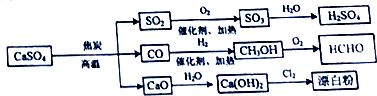

| A、漂白粉的主要成分为Ca(ClO)2 |
| B、蔗糖中加入浓硫酸,搅拌后产生大量的CO2、SO2、SO3 |
| C、SO2、CH3OH、HCHO 都能使酸性高锰酸溶液褪色 |
| D、CaO 是碱性氧化物,CO、SO2、SO3都是酸性氧化物 |
蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价)是一种罕见的颜料,也叫汉紫.它曾经在秦兵马俑彩绘中被分析出来,秦俑也是它最早的使用实物.歌曲《青花瓷》中所描绘的“瓶身描绘的牡丹一如你初妆”、“色白花青测锦鲤跃然于碗底”等也是其精彩应用.下列关于硅酸铜钡的说法不正确的是( )
| A、x等于6 |
| B、性质稳定,不易脱色 |
| C、易溶于强酸和强碱 |
| D、可用氧化物形式表示BaO?CuO?2SiO2 |
常温下,下列溶液中的微粒浓度关系不正确的是( )
| A、pH=5.3的NaHSO3溶液:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3) |
| B、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C、0.1mol?L-1 Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+2 c(H2CO3) |
| D、物质的量浓度相等的NH3?H2O和NH4Cl溶液等体积混合:c(Cl-)=c(NH3?H2O)+c(NH4+) |
下列说法不正确的是( )
| A、1869年俄国化学家门捷列夫发现了元素的性质随着原子序数的递增而呈周期性变化的规律 |
| B、1913年丹麦物理学家玻尔提出,原子核外的电子在一系列稳定的轨道上运动会吸收能量和放出能量 |
| C、1923年化学家提出了酸碱质子理论,凡是能给出质子的物质是酸,能接受质子的物质是碱,那么H2O可看作两性物质 |
| D、1940年我国化学专家侯德榜发明了侯氏制碱法,将NH3通往CO2的NaCl饱和溶液中生成溶解度较小的NaHCO3 |
 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如图,该电池工作时,下列说法不正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如图,该电池工作时,下列说法不正确的是( )| A、Mg电极是该电池的负极 |
| B、H2O2在石墨电极上的反应式:H2O2+2e-═2OH- |
| C、若隔膜为阳离子交换膜,则正极区有白色沉淀 |
| D、溶液中Cl-向石墨电极移动 |
