题目内容
氯气是一中重要的工业原料
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4
2CaSO4+2Cl2↑+2H2O.某学习小组利用此原理设计如图所示装置制取氯气并探究其性质.
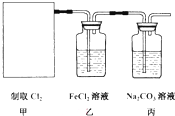
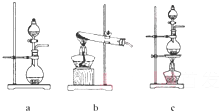
①在该实验中,甲部分的装置是 (填字母)
②证明乙装置中FeCl2与Cl2发生了氯化还原反应的实验方法是
③丙装置中通入少量Cl2,可制得某种生活中常用的具有漂白、消毒作用的物质.已知此反应的产物是3种钠盐,则丙中发生反应的化学方程是
④上述实验装置存在明显的缺陷,改进的方法是 .
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4
| ||

①在该实验中,甲部分的装置是

②证明乙装置中FeCl2与Cl2发生了氯化还原反应的实验方法是
③丙装置中通入少量Cl2,可制得某种生活中常用的具有漂白、消毒作用的物质.已知此反应的产物是3种钠盐,则丙中发生反应的化学方程是
④上述实验装置存在明显的缺陷,改进的方法是
考点:性质实验方案的设计,氯气的化学性质
专题:卤族元素
分析:(1)二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(2)①根据反应物状态和反应条件选取反应装置;
②可用KSCN溶液检验;
③氯气和水反应生成盐酸和次氯酸,盐酸和足量碳酸钠反应生成氯化钠和碳酸氢钠,次氯酸和碳酸钠反应生成次氯酸钠和碳酸氢钠;
④氯气有毒所以不能直接排空,所以缺少尾气处理装置.
(2)①根据反应物状态和反应条件选取反应装置;
②可用KSCN溶液检验;
③氯气和水反应生成盐酸和次氯酸,盐酸和足量碳酸钠反应生成氯化钠和碳酸氢钠,次氯酸和碳酸钠反应生成次氯酸钠和碳酸氢钠;
④氯气有毒所以不能直接排空,所以缺少尾气处理装置.
解答:
解:(1)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水,反应的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)①根据该反应知,反应物是固液混合的,反应条件是加热,所以该反应需要的装置是固液混合加热型装置,故答案为:c;
②可用KSCN溶液检验是否生成铁离子,方法是取少量反应后的溶液置于洁净的试管中,向其中滴加KSCN溶液,若产生红色溶液,证明生成了Fe3+,则FeCl2与Cl2发生了氧化还原反应,
故答案为:取少量反应后的溶液置于洁净的试管中,向其中滴加KSCN溶液,若产生红色溶液,证明生成了Fe3+,则FeCl2与Cl2发生了氧化还原反应;
③氯气和水反应生成盐酸和次氯酸,盐酸和足量碳酸钠反应生成氯化钠和碳酸氢钠,次氯酸和碳酸钠反应生成次氯酸钠和碳酸氢钠,所以方程式为Cl2+2Na2CO3+H2O=NaCl+NaClO+2NaHCO3,
故答案为:Cl2+2Na2CO3+H2O═NaCl+NaClO+2NaHCO3;
④氯气是有毒气体所以不能直接排空,故应在丙装置后连接一个盛有NaOH溶液的洗气瓶防止氯气污染空气,故答案为:在丙装置后连接一个盛有氢氧化钠溶液的洗气瓶.
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)①根据该反应知,反应物是固液混合的,反应条件是加热,所以该反应需要的装置是固液混合加热型装置,故答案为:c;
②可用KSCN溶液检验是否生成铁离子,方法是取少量反应后的溶液置于洁净的试管中,向其中滴加KSCN溶液,若产生红色溶液,证明生成了Fe3+,则FeCl2与Cl2发生了氧化还原反应,
故答案为:取少量反应后的溶液置于洁净的试管中,向其中滴加KSCN溶液,若产生红色溶液,证明生成了Fe3+,则FeCl2与Cl2发生了氧化还原反应;
③氯气和水反应生成盐酸和次氯酸,盐酸和足量碳酸钠反应生成氯化钠和碳酸氢钠,次氯酸和碳酸钠反应生成次氯酸钠和碳酸氢钠,所以方程式为Cl2+2Na2CO3+H2O=NaCl+NaClO+2NaHCO3,
故答案为:Cl2+2Na2CO3+H2O═NaCl+NaClO+2NaHCO3;
④氯气是有毒气体所以不能直接排空,故应在丙装置后连接一个盛有NaOH溶液的洗气瓶防止氯气污染空气,故答案为:在丙装置后连接一个盛有氢氧化钠溶液的洗气瓶.
点评:本题考查了氯气的性质,为高频考点,侧重于学生的分析、实验能力的考查,难度不大,注意把握实验的方法和操作注意事项,结合物质的性质解答该题.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
利用如图实验装置能完成相应实验的是( )
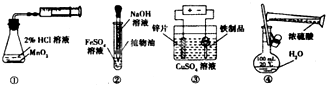

| A、装置①测定化学反应速率 |
| B、装置②制取少量的氢氧化亚铁 |
| C、装置③铁制品表面镀锌 |
| D、装置④稀释浓硫酸 |
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物,下列说法错误的是( )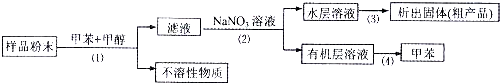

| A、步骤(1)需要用到过滤装置 |
| B、步骤(2)需要用到分液装置 |
| C、步骤(3)需要用到蒸发皿 |
| D、步骤(4)需要用到布氏漏斗 |
硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(如图).下列说法正确的是( )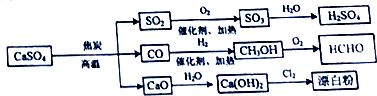

| A、漂白粉的主要成分为Ca(ClO)2 |
| B、蔗糖中加入浓硫酸,搅拌后产生大量的CO2、SO2、SO3 |
| C、SO2、CH3OH、HCHO 都能使酸性高锰酸溶液褪色 |
| D、CaO 是碱性氧化物,CO、SO2、SO3都是酸性氧化物 |
下列说法不正确的是( )
| A、1869年俄国化学家门捷列夫发现了元素的性质随着原子序数的递增而呈周期性变化的规律 |
| B、1913年丹麦物理学家玻尔提出,原子核外的电子在一系列稳定的轨道上运动会吸收能量和放出能量 |
| C、1923年化学家提出了酸碱质子理论,凡是能给出质子的物质是酸,能接受质子的物质是碱,那么H2O可看作两性物质 |
| D、1940年我国化学专家侯德榜发明了侯氏制碱法,将NH3通往CO2的NaCl饱和溶液中生成溶解度较小的NaHCO3 |
 某课外小组的同学收集了含水蒸气、一氧化碳和二氧化碳的废气,为确认这种废气中存在CO,他们在实验室按如图所示装置进行实验〔气体通过装置A速度很慢,假设在此处发生的反应完全;碱石灰(CaO和NaOH的混合物)过量〕.
某课外小组的同学收集了含水蒸气、一氧化碳和二氧化碳的废气,为确认这种废气中存在CO,他们在实验室按如图所示装置进行实验〔气体通过装置A速度很慢,假设在此处发生的反应完全;碱石灰(CaO和NaOH的混合物)过量〕. 某化学课外活动小组应用如图所示的方法研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气,回答下列问题.
某化学课外活动小组应用如图所示的方法研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气,回答下列问题.