题目内容
炼金废水中含有络离子[Au(CN)2]+,其电离出的CN-有毒,当H+结合生成HCN时,其毒性更强.回答下列问题:
(1)HCN的结构式为 ,电离方程式为 NaCN溶液的pH 7.
(2)与弱电解质碳酸的电离方式相似,[Au(CN)2]+也存在着两步电离,其一级电离方程式为
(3)处理这种废水时是在碱性条件下,NaClO将CN-氧化为CO32-和N2,其离子方程式为 ,
在酸性条件下,ClO-也能氧化成CN-,但实际处理废水时却不在酸性条件下进行的主要原因是 .
(1)HCN的结构式为
(2)与弱电解质碳酸的电离方式相似,[Au(CN)2]+也存在着两步电离,其一级电离方程式为
(3)处理这种废水时是在碱性条件下,NaClO将CN-氧化为CO32-和N2,其离子方程式为
在酸性条件下,ClO-也能氧化成CN-,但实际处理废水时却不在酸性条件下进行的主要原因是
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题
分析:(1)碳原子的成键情况主要根据与碳原子形成共价键的原子的数目确定;HCN是弱电解,部分电离,而NaCN是强碱弱酸盐水解呈碱性;
(2)与弱电解质的电离方程式相似,[Au(CN)2]+也存在着两步电离,第一步电离出一个CN-;
(3)处理这种废水是在碱性条件下,NaClO将CN-氧化为碳酸根和氮气,碱性条件下生成生成碳酸根离子;
(4)在酸性条件下,考虑CN-与氢离子结合,生成极弱的毒性非常强的HCN.
(2)与弱电解质的电离方程式相似,[Au(CN)2]+也存在着两步电离,第一步电离出一个CN-;
(3)处理这种废水是在碱性条件下,NaClO将CN-氧化为碳酸根和氮气,碱性条件下生成生成碳酸根离子;
(4)在酸性条件下,考虑CN-与氢离子结合,生成极弱的毒性非常强的HCN.
解答:
解:(1)HCN分子中有1个碳原子和1个氮原子,1个氢原子,碳是中心原子,采用sp2杂化,碳与氢形成单键,与氮形成三键,则结构式为H-C≡N,HCN是弱电解,部分电离,而NaCN是强碱弱酸盐水解呈碱性,故答案为:H-C≡N;HCN?H++CN-;>;
(2)与弱电解质的电离方程式相似,[Au(CN)2]+也存在着两步电离,第一步电离出一个CN-,电离方程式为[Au(CN)2]+?[Au(CN)]2++CN-,
故答案为:[Au(CN)2]+?[Au(CN)]2++CN-;
(3)处理这种废水是在碱性条件下,NaClO将CN-氧化为碳酸根和氮气,碱性条件下生成生成碳酸根离子,反应方程式为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O,故答案为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O;
(4)在酸性条件下,考虑CN-与氢离子结合,生成极弱的毒性非常强的HCN,故答案为:在酸性条件下CN-与氢离子结合,生成毒性非常强的HCN.
(2)与弱电解质的电离方程式相似,[Au(CN)2]+也存在着两步电离,第一步电离出一个CN-,电离方程式为[Au(CN)2]+?[Au(CN)]2++CN-,
故答案为:[Au(CN)2]+?[Au(CN)]2++CN-;
(3)处理这种废水是在碱性条件下,NaClO将CN-氧化为碳酸根和氮气,碱性条件下生成生成碳酸根离子,反应方程式为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O,故答案为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O;
(4)在酸性条件下,考虑CN-与氢离子结合,生成极弱的毒性非常强的HCN,故答案为:在酸性条件下CN-与氢离子结合,生成毒性非常强的HCN.
点评:本题考查弱电解质在水溶液中的电离,电解质溶液的酸碱性,以及氧化还原有关知识,比较容易.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法或表示方法正确的是( )
| A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B、由C(石墨)=C(金刚石)△H=+1.90kJ?mol-1 可知,金刚石比石墨稳定 |
| C、一定条件下,将0 5 mol N2(g)和1.5 molH2 (g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H═-38.6kJ?mol-1 |
| D、在稀溶液中,H+(aq)+OH-(aq)═H2O(Ⅰ)△H=-57.3kJ?mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ |
下列气体逐渐通入NaAlO2溶液中,开始时产生沉淀,继续通入气体时沉淀又溶解,该气体是( )
| A、CO2 |
| B、NO |
| C、H2S |
| D、NO2 |
向一定量Fe、FeO、Fe2O3的混合物中,加入50mL 1mol/L硫酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现.若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量为( )
| A、11.2g | B、2.8g |
| C、5.6g | D、无法计算 |
25℃时,弱酸的电离平衡常数如表所示,下列说法正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | Ka1:4.3×10-7 Ka2:5.6×10-11 |
| A、物质的量浓度相等的溶液pH关系:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B、a mol?L-1 HCN与b mol?L-1 NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b |
| C、向冰醋酸中逐滴加水至稀溶液过程中,溶液导电能力先增大,后减小 |
| D、将0.1 mol?L-1 的Na2CO3溶液逐滴加入到等浓度的HCN溶液中无明显现象,说明未反应 |
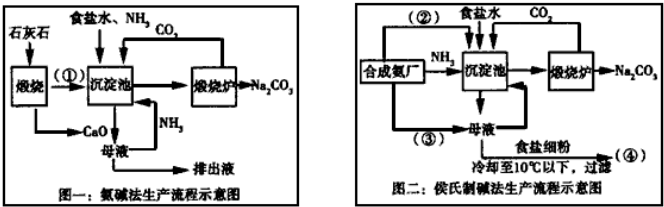
 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.

 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为