题目内容
12.下列排序不正确的是( )| A. | 气态氢化物稳定性 H2O<NH3<CH4 | B. | 微粒半径 Al3+<F-<Cl- | ||
| C. | 碱性 Mg(OH)2<NaOH<KOH | D. | 熔点 冰醋酸<食盐<金刚石 |
分析 A、元素的非金属性越强,则气态氢化物的稳定性越强;
B、电子层数越多,微粒半径越大;当电子层数相同时,核电荷数越多,半径越小;
C、元素的金属性越强,则对应碱的碱性越强;
D、熔点的高低:原子晶体>离子晶体>分子晶体.
解答 解:A、元素的非金属性越强,则气态氢化物的稳定性越强,由于非金属性C<N<O,故气态氢化物的稳定性:H2O>NH3>CH4,故A错误;
B、电子层数越多,微粒半径越大,由于Cl-有3个电子层,而Al3+、F-均有2个,故Cl-的半径最大;当电子层数相同时,核电荷数越多,半径越小,故Al3+的半径小于F-的,故微粒半径为Al3+<F-<Cl-,故B正确;
C、元素的金属性越强,则对应碱的碱性越强,由于金属性Mg<Na<K,故碱性Mg(OH)2<NaOH<KOH,故C正确;
D、熔点的高低:原子晶体>离子晶体>分子晶体,而金刚石是原子晶体,食盐是离子晶体,醋酸是分子晶体,故有熔点:冰醋酸<食盐<金刚石,故D正确.
故选A.
点评 本题考查了元素金属性、非金属性的强弱比较,难度不大,应注意的是比较微粒半径时,首先考虑电子层数,其次是核电荷数和核外电子数.

练习册系列答案
相关题目
3.向一定体积的BaCl2溶液中加入V mL的0.01mol/L H2SO4溶液,两者恰好完全反应,且反应后溶液的PH是3.0,原BaCl2溶液物质的量浓度是( )
| A. | 5.05×10-4mol/L | B. | 5.26×10-4mol/L | C. | 5.05×10-3mol/L | D. | 5.26×10-3mol/L |
20.下列说法正确的是( )
| A. |  分子中至少有9个碳原子处于同一平面上 分子中至少有9个碳原子处于同一平面上 | |
| B. |  的核磁共振氢谱有5个峰 的核磁共振氢谱有5个峰 | |
| C. | 某烯烃与氢气加成后得到2,2-二甲基丁烷,该烯烃的名称是3,3-二甲基-1-丁烯 | |
| D. | 能够测定分子化学键的方法是核磁共振谱 |
7.下列有关化学实验的说法错误的是( )
| A. | 为了除去NaCl溶液中的MgCl2,可加氢氧化钠溶液至溶液呈中性 | |
| B. | 稀释浓硫酸时,将水沿烧杯内壁注入浓硫酸中,并用玻璃棒不断搅拌 | |
| C. | 某试样与NaOH浓溶液共热,产生使湿润红色石蕊试纸变蓝的气体,则试样中含有NH4+ | |
| D. | 做完实验后,剩余的金属钠应放回试剂瓶以消除安全隐患 |
17.向某晶体的溶液中加入Fe2+后溶液无明显变化,再滴加几滴氯水后,混合液出现血红色,由此得出的下列结论错误的是( )
| A. | Fe2+不能与SCN-形成血红色化合物 | B. | 该晶体中一定含有SCN- | ||
| C. | Fe3+的氧化性比氯气的氧化性强 | D. | Fe2+被氯气氧化成Fe3+ |
4.下列说法错误的是( )
| A. | 已烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| B. | 在一定条件下,苯与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 新型生物柴油和矿物油主要化学成分不相同 |

 .
.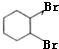 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O,反应类型消去反应;
+2NaBr+2H2O,反应类型消去反应;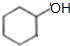 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,反应类型消去反应;
+H2O,反应类型消去反应;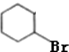 +H2O,反应类型取代反应;
+H2O,反应类型取代反应; +2H2O.
+2H2O.