题目内容
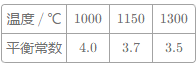
【题目】CO、CO2的应用和治理是当今社会的热点问题。CO工业上可用于高炉炼铁,发生如下反应:1/3Fe2O3(s)+CO(g)2/3Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表:
(1)该反应的正反应为_______反应(填“放热”或“吸热”),欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是___________(选填序号)
a、及时吸收或移出CO2 b、增大反应体系的压强。
c、使用更高效的催化。 d、粉碎矿石增大接触面积
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:2Fe (s) +CO2 (g)FeO(s) +CO (g) –Q,该反应的平衡常数表达式K=____________。下列措施中能使平衡时c(CO)/c(CO2)增大的是___________(选填编号)。
a.升高温度 b.增大压强
c.充入一定量一氧化碳在 d.再加入一些铁粉
【答案】放热 a ![]() a
a
【解析】
(1)由表中数据可知,温度升高,K值减小,即反应逆向移动,而升温平衡向吸热反应方向移动,则正反应为放热反应;欲提高CO的平衡转化率,促进Fe2O3的转化,根据影响平衡移动的因素逐项进行分析;
(2)平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,固体和纯液体不代入表达式;![]() ,则该比值就是平衡常数,而平衡常数只与温度有关,温度不变,K值不变,且正反应为吸热反应,则升温正向移动,平衡常数增大。
,则该比值就是平衡常数,而平衡常数只与温度有关,温度不变,K值不变,且正反应为吸热反应,则升温正向移动,平衡常数增大。
(1)由表中数据可知升高温度,平衡常数减小,则正反应为放热反应;
a.及时吸收或移出CO2 ,平衡正向移动,反应物转化率增大,a项正确;
b.增大反应体系的压强,平衡不移动,粉碎矿石,增大接触面积,只能加快反应速率,不影响平衡移动,b项错误;
c.用更高效的催化剂,只能加快反应速率,不影响平衡移动,c项错误;
d.粉碎矿石,增大接触面积,只能加快反应速率,不影响平衡移动,d项错误;故答案为:放热;a;
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)△H>0,该反应的平衡常数表达式K=
FeO(s)+CO(g)△H>0,该反应的平衡常数表达式K=![]() ;
;
a.正反应为吸热反应,升高温度,平衡正向移动,a项正确;
b.增大压强,平衡不一定,b项错误;
c.充入一定量CO,相当于增大压强,比值不变,c项错误;
d.再加入一些铁粉,平衡不移动,d项错误;故答案为:![]() ;a。
;a。

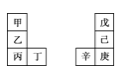
【题目】在恒温恒容的密闭容器中按照下表甲、乙、丙三种方式分别投料,发生反应:3H2(g)+N2(g) ![]() 2NH3(g),测得甲容器中H2的平衡转化率为 40%,下列说法正确的是( ).
2NH3(g),测得甲容器中H2的平衡转化率为 40%,下列说法正确的是( ).
N2(mol) | H2(mol) | NH3(mol) | |
甲 | 1 | 3 | 0 |
乙 | 0.5 | 1.5 | 1 |
丙 | 0 | 0 | 4 |
A.乙容器中反应向逆向进行
B.达到平衡时,甲、乙、丙三容器中NH3体积分数的大小顺序:甲=乙>丙
C.乙中的NH3转化率为40%
D.若丙在恒温恒压的密闭容器进行,平衡后往容器中再充入4 mol NH3,重新达到平衡时,体系中NH3体积分数不变