题目内容
现有常温下的0.1mol/L纯碱溶液.
(1)该溶液呈碱性的原因是(用离子方程式表示) ;
为了说明上述观点,请设计一个简单的实验,简述实验过程: ;
(2)同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO3 2-不超过其总量的10%.请设计实验证明该同学的观点是否正确: ;
(3)同学乙就该溶液中粒子之间的关系写出了下列四个关系式,其中正确的是 ;
A.c(Na+)=2c(CO3 2-)
B.c(CO3 2-)>c(OH-)>c(HCO3 -)>c(H2CO3)
C.c(CO3 2-)+c(HCO3 -)=0.1mol/L
D.c(OH-)=c(H+)+c(HCO3 -)+2c(H2CO3)
(4)水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kh表示),请写出Na2CO3第一步水解反应的水解常数的表示式: .
(1)该溶液呈碱性的原因是(用离子方程式表示)
为了说明上述观点,请设计一个简单的实验,简述实验过程:
(2)同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO3 2-不超过其总量的10%.请设计实验证明该同学的观点是否正确:
(3)同学乙就该溶液中粒子之间的关系写出了下列四个关系式,其中正确的是
A.c(Na+)=2c(CO3 2-)
B.c(CO3 2-)>c(OH-)>c(HCO3 -)>c(H2CO3)
C.c(CO3 2-)+c(HCO3 -)=0.1mol/L
D.c(OH-)=c(H+)+c(HCO3 -)+2c(H2CO3)
(4)水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kh表示),请写出Na2CO3第一步水解反应的水解常数的表示式:
考点:盐类水解的原理,离子浓度大小的比较,物质检验实验方案的设计
专题:
分析:(1)碳酸根离子水解生成氢氧根离子溶液显碱性,设计实验有碳酸根离子时溶液显碱性,除去碳酸根离子后溶液不显碱性;
(2)用pH试纸测pH值计算水解产生的氢氧根离子的浓度;
(3)根据电荷守恒、物料守恒和质子守恒分析;
(4)水解平衡常数等于生成物浓度系数次幂之积与反应物浓度系数次幂之积的比.
(2)用pH试纸测pH值计算水解产生的氢氧根离子的浓度;
(3)根据电荷守恒、物料守恒和质子守恒分析;
(4)水解平衡常数等于生成物浓度系数次幂之积与反应物浓度系数次幂之积的比.
解答:
解:(1)碳酸根离子水解生成氢氧根离子溶液显碱性,其水解方程式为:CO32-+H2O?HCO3-+OH-,设计实验有碳酸根离子时溶液显碱性,除去碳酸根离子后溶液不显碱性,其操作为:取0.1mol/L的纯碱溶液少许于试管中,滴入几滴酚酞,溶液呈红色,再滴加足量BaCl2溶液,若溶液红色退去,则证明纯碱溶液显碱性的原因是CO32-水解;
故答案为:CO32-+H2O?HCO3-+OH-;取0.1mol/L的纯碱溶液少许于试管中,滴入几滴酚酞,溶液呈红色,再滴加足量BaCl2溶液,若溶液红色退去,则证明纯碱溶液显碱性的原因是CO32-水解;
(2)用pH试纸测pH值计算水解产生的氢氧根离子的浓度,其操作为:用pH试纸测0.1mol/L的Na2CO3溶液的pH,若pH<12,则证明水解的CO32-不超过其总量的10%,故答案为:用pH试纸测0.1mol/L的Na2CO3溶液的pH,若pH<12,则证明水解的CO32-不超过其总量的10%;
(3)A.根据物料守恒,碳元素在溶液中的形式有:CO32-、HCO3-、H2CO3、所以c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故A错误;
B.溶液中存在两步水解:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,以第一步水解为主,所以c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3),故B正确;
C.根据物料守恒:c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol?L-1,故C错误;
D.根据质子守恒:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故D正确;
故答案为:BD;
(4)纯碱溶液中CO32-+H2O?HCO3-+OH-,则Kh=
,
故答案为:Kh=
.
故答案为:CO32-+H2O?HCO3-+OH-;取0.1mol/L的纯碱溶液少许于试管中,滴入几滴酚酞,溶液呈红色,再滴加足量BaCl2溶液,若溶液红色退去,则证明纯碱溶液显碱性的原因是CO32-水解;
(2)用pH试纸测pH值计算水解产生的氢氧根离子的浓度,其操作为:用pH试纸测0.1mol/L的Na2CO3溶液的pH,若pH<12,则证明水解的CO32-不超过其总量的10%,故答案为:用pH试纸测0.1mol/L的Na2CO3溶液的pH,若pH<12,则证明水解的CO32-不超过其总量的10%;
(3)A.根据物料守恒,碳元素在溶液中的形式有:CO32-、HCO3-、H2CO3、所以c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故A错误;
B.溶液中存在两步水解:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,以第一步水解为主,所以c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3),故B正确;
C.根据物料守恒:c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol?L-1,故C错误;
D.根据质子守恒:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故D正确;
故答案为:BD;
(4)纯碱溶液中CO32-+H2O?HCO3-+OH-,则Kh=
| c(HCO3-).c(OH-) |
| c(CO32-) |
故答案为:Kh=
| c(HCO3-).c(OH-) |
| c(CO32-) |
点评:本题考查了盐类水解的原理,溶液酸碱性的实验测定方法,溶液中的守恒关系的应用,题目难度中等,侧重于对学生基础知识的综合应用能力的考查.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
甲、乙、丙为二、三周期的元素,原子序数依次增大,甲和乙同周期,甲和丙同主族,甲、乙原子序数之和与丙的原子序数相等,甲、丙原子的最外层电子数之和与乙原子的电子总数相等.下列说法中不正确的是( )
| A、乙是地壳中含量最多的元素 |
| B、丙的氢化物比甲的氢化物热稳定性强 |
| C、乙与丙形成的化合物可制作光导纤维 |
| D、甲、乙两种元素形成的化合物中可能既含离子键又含有共价键 |
水热法制备直径为1~100nm的颗粒Y(化合物),反应原理为:3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O,下列说法中不正确的是( )
| A、a=4 |
| B、O2是氧化剂 |
| C、将Y均匀分散到水中形成的体系具有丁达尔效应 |
| D、每有3 mol Fe2+参加反应,反应中转移的电子总数为5 mol |
实验室需配制一种强酸溶液500mL,且要求c (H+)=2mol/L,下列配制方法可行的是( )
| A、取100mL5mol/LH2SO4,加入400mL水 |
| B、取200mL5mol/LHCl,加水稀释至500mL |
| C、取100 mL5mol/LH2SO4,加水500mL |
| D、取100 mL5mol/LHNO3,加水稀释至500mL |
关于1molH2O的说法正确的是( )
| A、质量18g |
| B、体积22.4L |
| C、分子数为1 |
| D、含有O原子的物质的量为2mol |
摩尔是( )单位.
| A、质量 | B、密度 |
| C、相对分子质量 | D、物质的量 |
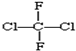 和
和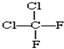 ; ⑨
; ⑨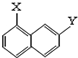 和
和 .
.