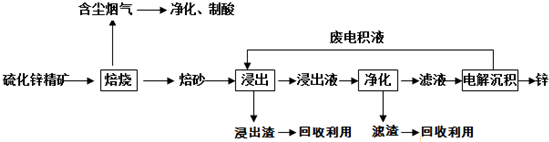
题目内容
19.美国药物学家最近合成一种可能用于治疗高血压的有机物K,合成路线如下: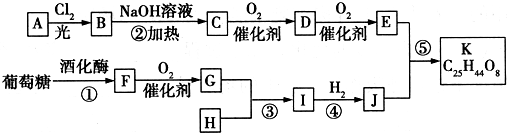
已知:R1CHO+R2CH2CHO→
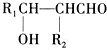
其中A属于碳氢化合物,其中碳的质量分数约为83.3%;E的核磁共振氢谱中只有2组吸收峰.H常温下呈气态,是室内装潢产生的主要污染物之一.G和H以1:3反应生成I.
试回答下列问题:
(1)A的分子式为:C5H12.
(2)写出下列物质的结构简式:D:
 ;G:CH3CHO.
;G:CH3CHO.(3)反应①-⑤中属于取代反应的有②⑤.
(4)反应①的化学方程式为C6H12O6 $\stackrel{酒化酶}{→}$ 2C2H5OH+2CO2↑;反应④的化学方程式为
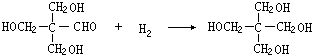 .
.(5)E有多种同分异构体,符合“既能发生银镜反应又能发生水解反应”条件的E的同分异构体有4种,写出符合上述条件且核磁共振氢谱只有2组吸收峰的E的同分异构体的结构简式:HCOOC(CH3)3.
分析 A属于碳氢化合物,其中碳的质量分数约为83.3%,则分子中C、H原子数目之比为$\frac{83.3%}{12}$:$\frac{1-83.3%}{1}$=5:12,则A为C5H12,A与氯气发生取代反应生成B,B发生水解反应得到C,C可以连续发生氧化反应得到E,E的核磁共振氢谱中只有2组吸收峰,则E为 ,可推知A为
,可推知A为 ,B为
,B为 ,C为
,C为 ,D为
,D为 .葡萄糖在酒化酶作用下得到F为C2H5OH,F发生氧化反应生成G为CH3CHO,H常温下呈气态,是室内装潢产生的主要污染物之一,则H为HCHO,G和H以1:3反应生成I,则I为
.葡萄糖在酒化酶作用下得到F为C2H5OH,F发生氧化反应生成G为CH3CHO,H常温下呈气态,是室内装潢产生的主要污染物之一,则H为HCHO,G和H以1:3反应生成I,则I为 ,I与氢气发生加成反应生成J为
,I与氢气发生加成反应生成J为 ,J与E发生酯化反应生成K为
,J与E发生酯化反应生成K为 .
.
解答 解:A属于碳氢化合物,其中碳的质量分数约为83.3%,则分子中C、H原子数目之比为$\frac{83.3%}{12}$:$\frac{1-83.3%}{1}$=5:12,则A为C5H12,A与氯气发生取代反应生成B,B发生水解反应得到C,C可以连续发生氧化反应得到E,E的核磁共振氢谱中只有2组吸收峰,则E为 ,可推知A为
,可推知A为 ,B为
,B为 ,C为
,C为 ,D为
,D为 .葡萄糖在酒化酶作用下得到F为C2H5OH,F发生氧化反应生成G为CH3CHO,H常温下呈气态,是室内装潢产生的主要污染物之一,则H为HCHO,G和H以1:3反应生成I,则I为
.葡萄糖在酒化酶作用下得到F为C2H5OH,F发生氧化反应生成G为CH3CHO,H常温下呈气态,是室内装潢产生的主要污染物之一,则H为HCHO,G和H以1:3反应生成I,则I为 ,I与氢气发生加成反应生成J为
,I与氢气发生加成反应生成J为 ,J与E发生酯化反应生成K为
,J与E发生酯化反应生成K为 .
.
(1)A的分子式为:C5H12,故答案为:C5H12;
(2)D的结构简式: ;G的结构简式:CH3CHO,
;G的结构简式:CH3CHO,
故答案为: ;CH3CHO;
;CH3CHO;
(3)反应①-⑤中属于取代反应的有②⑤,故答案为:②⑤;
(4)反应①的化学方程式为:C6H12O6 $\stackrel{酒化酶}{→}$ 2C2H5OH+2CO2↑,
反应④的化学方程式为: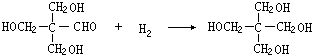 ,
,
故答案为:C6H12O6 $\stackrel{酒化酶}{→}$ 2C2H5OH+2CO2↑;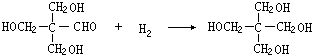 ;
;
(5)E( )有多种同分异构体,符合“既能发生银镜反应又能发生水解反应”条件的E的同分异构体为甲酸形成的酯,醇可以是1-丁醇、2-丁醇、2-甲基-1-丙醇、2-甲基-2丙醇,故共有4种,磁共振氢谱只有2组吸收峰的E的同分异构体的结构简式:HCOOC(CH3)3,
)有多种同分异构体,符合“既能发生银镜反应又能发生水解反应”条件的E的同分异构体为甲酸形成的酯,醇可以是1-丁醇、2-丁醇、2-甲基-1-丙醇、2-甲基-2丙醇,故共有4种,磁共振氢谱只有2组吸收峰的E的同分异构体的结构简式:HCOOC(CH3)3,
故答案为:4;HCOOC(CH3)3.
点评 本题考查有机物的合成与推断,计算确定A的分子式,再结合反应条件与E的结构特点判断,熟练掌握官能团的性质与转化,难度中等.

| A. | 若溶液pH=7,则c(A-)=c(HA) | |
| B. | 若c(A-)>c(HA),则溶液中水电离的c(H+)<1.0×10-7mol/L | |
| C. | 若pH>7,加水稀释c(A-)/c(HA)增大 | |
| D. | 溶液中,c(A-)=2c(H+)+c(HA)-2c(OH-) |
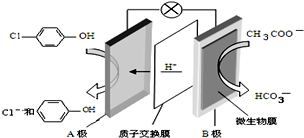 污水治理越来越引起人们重视,可以通过膜电池除去废水
污水治理越来越引起人们重视,可以通过膜电池除去废水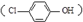 中的乙酸钠和对氯苯酚,其原理如图所示,下列说法不正确的( )
中的乙酸钠和对氯苯酚,其原理如图所示,下列说法不正确的( )| A. | A为电池的正极,发生还原反应 | |
| B. | 电流方向从B极沿导线经小灯泡流向A极 | |
| C. | A极的电极反应式为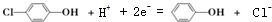 | |
| D. | 当外电路中有0.2mole-转移时,进入A极区的H+的个数为0.2NA |
| A. | 4种 | B. | 8种 | C. | 10种 | D. | 12种 |
| A. | [NH4+]>[Cl-]>[OH-]>[H+] | B. | [NH4+]=[Cl-]>[H+]=[OH-] | C. | [Cl-]>[NH4+]>[OH-]>[H+] | D. | [OH-]>[NH4+]>[H+]>[Cl-] |
 亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:
亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题: 某有机物A的分子式为C6H12O2,已知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均能发生银镜反应,则A的结构可能有( )
某有机物A的分子式为C6H12O2,已知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均能发生银镜反应,则A的结构可能有( )