题目内容
14.关于电池,以下叙述不正确的是( )| A. | 化学电池的反应本质是氧化还原反应 | |
| B. | 最早使用的化学电池是锌锰电池 | |
| C. | 最早使用的充电电池是铅蓄电池 | |
| D. | 二次电池的放电反应与充电反应可能是可逆反应 |
分析 A、原电池是在两极分别发生氧化和还原反应,外电路电子的定向移动;
B、最早使用的充电电池是铅蓄电池,而锌锰电池是一次性电池;
C、最早使用的充电电池是铅蓄电池;
D、可逆反应必须反应条件相同.
解答 解:A、原电池是在两极分别发生氧化和还原反应,外电路电子的定向移动,所以化学电池的反应本质是氧化还原反应,故A正确;
B、最早使用的充电电池是铅蓄电池,而锌锰电池是一次性电池,故B正确;
C、最早使用的充电电池是铅蓄电池,故C正确;
D、放电过程是原电池,是自发的氧化还原反应;而充电过程是电解池,是非自发的氧化还原反应,是用电流强迫电解质溶液在两极发生氧化还原反应,因为条件不一样,所以它们是不可逆的,故D错误;
故选D.
点评 本题考查了原电池和电能的有关知识,难度不大,明确充电电池的放电反应与充电反应不互为可逆反应.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
9.将纯锌片和纯铜片按下图插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
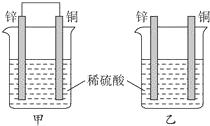

| A. | 两烧杯中溶液的pH值均增大 | B. | 产生气泡的速率甲比乙快 | ||
| C. | 两烧杯中铜片表面均无气泡产生 | D. | 甲中铜片是正极,乙中锌片是负极 |
19.下列化合物中,既有离子键,又有共价键且是非极性共价键的是( )
| A. | NaOH | B. | Na2O2 | C. | KHSO4 | D. | NH4Cl |
6.下列说法正确的是( )
| A. | 离子键是阴、阳离子之间的相互吸引力 | |
| B. | 电能是一种使用最方便、污染最小的一次能源 | |
| C. | 由分子构成的物质中一定存在共价键 | |
| D. | 决定化学反应速率的主要因素是反应物体本身的性质 |
4.关于化学键的下列叙述正确的是( )
| A. | 离子化合物中只含离子键 | B. | 共价化合物中不含离子键 | ||
| C. | 离子化合物中不可能含共价键 | D. | 共价化合物中可能含离子键 |
 .
. .
.


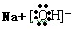 ,含有化学键的类型离子键、极性键;
,含有化学键的类型离子键、极性键;