题目内容
在如图装置中,a为Fe,b为碳棒,关于此装置的各种叙述正确的是( )


| A、a电极上有气体放出,b电极上无气泡,溶液pH变大 |
| B、a是正极,b是负极 |
| C、导线中有电子流动,外电路中,电子从a极到b极 |
| D、a极上发生了还原反应 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:a的活动性比氢要强,b为碳棒,该装置能自发的发生氧化还原反应而构成原电池,a作负极,碳棒作正极,负极上金属失电子发生氧化反应,碳棒上氢离子得电子发生还原反应,电子从负极沿导线流向正极.
解答:
解:A.该原电池中金属作负极,碳棒b作正极,负极上金属失电子发生氧化反应,正极碳上氢离子得电子发生还原反应,则b电极上有气泡,溶液的PH增大,故A错误;
B.该原电池中,金属的金属性大于氢元素,所以金属a作负极,碳棒b作正极,故B错误;
C.原电池中,电子从负极a沿导线流向正极b,故C正确;
D.a作负极,负极上失电子发生氧化反应,故D错误;
故选:C.
B.该原电池中,金属的金属性大于氢元素,所以金属a作负极,碳棒b作正极,故B错误;
C.原电池中,电子从负极a沿导线流向正极b,故C正确;
D.a作负极,负极上失电子发生氧化反应,故D错误;
故选:C.
点评:本题考查了原电池工作原理.原电池中正负极的判断不能仅凭金属的活泼性判断,要根据电极反应的反应类型、电子的流向等方面判断.

练习册系列答案
相关题目
t℃时CuSO4的溶解度是S g,其饱和溶液密度d g.cm-3、物质的量浓度为c mol.L-1.向足量饱和溶液中加入m g无水CuSO4或蒸发掉n g水后恢复t℃,均能获得W g胆矾晶体,下列关系式正确的是( )
A、c=
| ||
B、S=
| ||
C、m=
| ||
D、W=
|
观察如图几个装置示意图,有关叙述正确的是( )
A、装置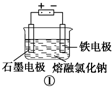 工业上可用于生产金属钠,电解过程中石墨电极产生金属,此法也可用于生产活泼金属镁、铝等 工业上可用于生产金属钠,电解过程中石墨电极产生金属,此法也可用于生产活泼金属镁、铝等 |
B、装置 中随着电解的进行左边电极会产生红色的铜,并且电流表示数不断变小 中随着电解的进行左边电极会产生红色的铜,并且电流表示数不断变小 |
C、装置 中的离子交换膜只允许阳离子、阴离子和小分子水通过 中的离子交换膜只允许阳离子、阴离子和小分子水通过 |
D、装置 的待镀铁制品应与电源正极相连 的待镀铁制品应与电源正极相连 |
下列化学变化中,必须加入氧化剂才能实现的是( )
| A、SO2→H2SO3 |
| B、Cl2→NaClO |
| C、Fe→FeCl2 |
| D、HNO3→O2 |
短周期元素E的氯化物ECln的熔点为-78℃,沸点为59℃;若0.2mol ECln与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀.下列判断错误的是( )
| A、E是一种非金属元素 |
| B、在ECln中E与Cl之间形成共价键 |
| C、E的一种常见氧化物为EO |
| D、E位于元素周期表的ⅥA族 |
下列关于化石燃料及其加工说法正确的是( )
| A、天然气和沼气的主要成分都是甲烷,二者都是不可再生资源 |
| B、石油分馏和煤千馏都是物理变化,前者可得到汽油、煤油等,后者主要得到焦炭、煤焦油、粗氨水和焦炉气 |
| C、石油裂化主要是为了提高轻质油的产量,尤其是汽油的产量 |
| D、煤的液化指的是把煤加热到熔点以上使其变成液体 |

 如图为一个电化学过程的示意图.请回答下列问题:
如图为一个电化学过程的示意图.请回答下列问题: