题目内容
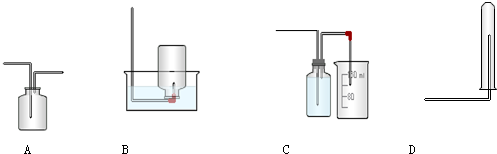
实验室常用的几种气体发生装置如图所示:

(1)实验室里用乙醇和浓硫酸共热制取乙烯, (填“能”或“不能”)能否选用上述装置来完成实验;如果不能,应该选用哪种装置并在此装置上作什么改进即可完成该实验? .
(2)实验室制取HCl气体可选用A,用氯化钠和浓硫酸共热而得;若仅有浓硫酸与浓盐酸,选用装置 也可以制取HCl气体,下列叙述不属于制取HCl气体理由的是
A、浓硫酸具有脱水性; B、浓硫酸具有吸水性
C、盐酸具有挥发性; D、气态物质的溶解性随温度的升高而降低
(3)现有两种方法制取氧气,可供选用的药品有:KClO3、Na2O2、NaOH、H2O、Na2CO3、MnO2.若选装置B,则需选用的试剂为 ;若选装置C,则需选用的试剂为 .
(4)若把装置图1中的A与图2相连,在实验室可用来制取下列气体中的 (填序号)
①NO2 ②Cl2 ③HCl ④NH3
写出实验室制取该气体的化学方程式: 图2小烧杯所盛液体的作用为 .

(1)实验室里用乙醇和浓硫酸共热制取乙烯,
(2)实验室制取HCl气体可选用A,用氯化钠和浓硫酸共热而得;若仅有浓硫酸与浓盐酸,选用装置
A、浓硫酸具有脱水性; B、浓硫酸具有吸水性
C、盐酸具有挥发性; D、气态物质的溶解性随温度的升高而降低
(3)现有两种方法制取氧气,可供选用的药品有:KClO3、Na2O2、NaOH、H2O、Na2CO3、MnO2.若选装置B,则需选用的试剂为
(4)若把装置图1中的A与图2相连,在实验室可用来制取下列气体中的
①NO2 ②Cl2 ③HCl ④NH3
写出实验室制取该气体的化学方程式:
考点:乙醇的消去反应,常见气体制备原理及装置选择,实验装置综合
专题:实验设计题
分析:(1)实验室中用乙醇制取乙烯气体,需要用温度计控制反应温度,图示装置中缺少温度计;根据乙醇制取乙烯的反应原理选择装置并改进装置;
(2)浓硫酸和浓盐酸都是液体,需要在圆底烧瓶中反应;浓硫酸与浓盐酸制取氯化氢的反应中,浓硫酸表现了吸水性,不是脱水性;
(3)根据提供的装置特点、化学试剂的性质进行解答,如杂质B要求反应物为固体,装置C要求反应物中至少有一种为液体,据此进行解答;
(4)根据装置特点及气体的性质判断装置图1中的A与图2相连可以制取的气体;根据反应原理写出反应的化学方程式;小烧杯中液体用于吸收尾气,防止污染.
(2)浓硫酸和浓盐酸都是液体,需要在圆底烧瓶中反应;浓硫酸与浓盐酸制取氯化氢的反应中,浓硫酸表现了吸水性,不是脱水性;
(3)根据提供的装置特点、化学试剂的性质进行解答,如杂质B要求反应物为固体,装置C要求反应物中至少有一种为液体,据此进行解答;
(4)根据装置特点及气体的性质判断装置图1中的A与图2相连可以制取的气体;根据反应原理写出反应的化学方程式;小烧杯中液体用于吸收尾气,防止污染.
解答:
解:(1)图示装置中缺少温度计,无法控制反应温度,所以不能用于制取乙烯;制取乙烯需要加热、反应在圆底烧瓶中进行,所以应该选用装置A,且应该把双孔塞换成三孔塞,增加一支温度计,
故答案为:不能;把装置A中圆底烧瓶的双孔塞换成三孔塞,增加一支温度计;
(2)实验室制取HCl气体可选用A,氯化氢具有挥发性,用氯化钠和浓硫酸共热而得;若仅有浓硫酸与浓盐酸,也可以选用装置C,利用了浓硫酸的吸水性、氯化氢的挥发性及浓硫酸与浓盐酸混合放出热量,温度升高可以降低气体的溶解度,所以BCD正确,没有利用浓硫酸的脱水性,所以A错误,
故答案为:C;A;
(3)现有两种方法制取氧气,可供选用的药品有:KClO3、Na2O2、NaOH、H2O、Na2CO3、MnO2;若选装置B,则反应物为固体,需选用的试剂为KClO3、MnO2,氯酸钾在二氧化锰作催化剂条件下反应生成氯化钾和氧气;若选装置C,则要求反应物中有一种为液态,需选用的试剂可以为Na2O2、H2O,二者反应生成氢氧化钠和氧气,
故答案为:KClO3、MnO2; Na2O2、H2O;
(4)若把装置图1中的A与图2相连,浓硫酸只能干燥酸性气体,该装置不能制取氨气;实验室制取二氧化氮不需要加热;所以可制取的气体为②Cl2 ③HCl,反应方程式分别为:MnO2+4HCl(浓)
Cl2↑+MnCl2+2H2O、2NaCl+H2SO4(浓)
2HCl↑+Na2SO4;小烧杯中液体用于吸收多余的氯化氢和氯气,防止污染空气,
故答案为:②③;MnO2+4HCl(浓)
Cl2↑+MnCl2+2H2O、2NaCl+H2SO4(浓)
2HCl↑+Na2SO4;吸收多余的Cl2防止污染大气.
故答案为:不能;把装置A中圆底烧瓶的双孔塞换成三孔塞,增加一支温度计;
(2)实验室制取HCl气体可选用A,氯化氢具有挥发性,用氯化钠和浓硫酸共热而得;若仅有浓硫酸与浓盐酸,也可以选用装置C,利用了浓硫酸的吸水性、氯化氢的挥发性及浓硫酸与浓盐酸混合放出热量,温度升高可以降低气体的溶解度,所以BCD正确,没有利用浓硫酸的脱水性,所以A错误,
故答案为:C;A;
(3)现有两种方法制取氧气,可供选用的药品有:KClO3、Na2O2、NaOH、H2O、Na2CO3、MnO2;若选装置B,则反应物为固体,需选用的试剂为KClO3、MnO2,氯酸钾在二氧化锰作催化剂条件下反应生成氯化钾和氧气;若选装置C,则要求反应物中有一种为液态,需选用的试剂可以为Na2O2、H2O,二者反应生成氢氧化钠和氧气,
故答案为:KClO3、MnO2; Na2O2、H2O;
(4)若把装置图1中的A与图2相连,浓硫酸只能干燥酸性气体,该装置不能制取氨气;实验室制取二氧化氮不需要加热;所以可制取的气体为②Cl2 ③HCl,反应方程式分别为:MnO2+4HCl(浓)
| ||
| ||
故答案为:②③;MnO2+4HCl(浓)
| ||
| ||
点评:本题考查了常见气体的制备原理及装置的选择,题目难度中等,明确常见气体的性质及实验室制法为解答本题的关键,注意掌握常见气体的实验室制法,能够正确书写反应的化学方程式.

练习册系列答案
相关题目
下列溶液中溶质的物质的量浓度为1mol?L-1的是( )
| A、将40 g NaOH溶解于1 L水中配成的NaOH溶液 | ||
| B、常温常压下,将22.4 L HCl 气体溶于水配成1 L的盐酸溶液 | ||
C、将1 L 0.5 mol?L-1的浓盐酸加热浓缩为
| ||
| D、从1000 mL 1 mol?L-1 NaCl溶液中取出100 mL的溶液 |
下列说法正确的是( )
| A、可逆反应的特征是正反应速率等于逆反应速率 |
| B、在其他条件不改变时,增大压强对溶液间反应几乎无影响 |
| C、温度升高,可以使可逆反应正反应速率加快,但逆反应速率可以不变 |
| D、化学反应的限度是不可改变的 |
 CH2=CH2+R1CH=CHR2
CH2=CH2+R1CH=CHR2
 反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论:
反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论: