题目内容
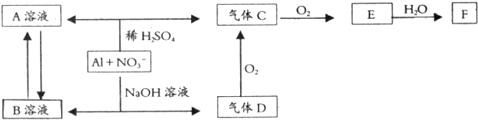
 A、B、C、D为中学化学四种常见物质,A为红棕色气体,它们之间的相互转化关系如图.已知:A+H2O→M+C;D+H2O→N,M、N是酸雨的主要成分.
A、B、C、D为中学化学四种常见物质,A为红棕色气体,它们之间的相互转化关系如图.已知:A+H2O→M+C;D+H2O→N,M、N是酸雨的主要成分.(1)写出下列反应化学方程式
①A+H2O→M+C
②A+B→C+D
(2)下列哪些物质不能与N的浓溶液反应
(3)下列实验方案可以用于在实验室制取B的是
a.Na2SO3溶液与HNO3 b.Na2SO3固体与浓硫酸
c.固体硫在纯氧中燃烧 d.铜与浓H2SO4加热
(4)某同学认为:将A通入到Na2S溶液中能够证明A的氧化性,此说法是否正确
考点:无机物的推断
专题:推断题
分析:A为红棕色气体,则A为NO2,与水反应生成M为HNO3,C为NO;D+H2O→N,M、N是酸雨的主要成分,则D为SO3,N为H2SO4,则B应为SO2,然后结合物质的性质及气体的制备原理来解答.
解答:
解:A为红棕色气体,则A为NO2,与水反应生成M为HNO3,C为NO;D+H2O→N,M、N是酸雨的主要成分,则D为SO3,N为H2SO4,则B应为SO2,
(1)①A+H2O→M+C的反应为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
②A+B→C+D的反应为NO2+SO2=NO+SO3,故答案为:NO2+SO2=NO+SO3;
(2)N的浓溶液具有强氧化性和酸性,可与氨气反应生成盐,与硫化氢发生氧化还原反应,只有b、c不反应,故答案为:b、c;
(3)a.Na2SO3溶液与HNO3发生氧化还原反应生成NO,不生成B二氧化硫,故错误;
b.Na2SO3固体与浓硫酸发生复分解反应生成B,故正确;
c.固体硫在纯氧中燃烧,反应生成二氧化硫,但气体收集不易操作,故错误;
d.铜与浓H2SO4加热,发生氧化还原反应生成二氧化硫,故正确;
故答案为:b、d;
(4)将A通入到Na2S溶液中不能够证明A的氧化性,是因NO2和水反应生成的HNO3是一种氧化性酸,也能将Na2S氧化,使溶液变浑浊,
故答案为:否;NO2和水反应生成的HNO3是一种氧化性酸,也能将Na2S氧化,使溶液变浑浊.
(1)①A+H2O→M+C的反应为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
②A+B→C+D的反应为NO2+SO2=NO+SO3,故答案为:NO2+SO2=NO+SO3;
(2)N的浓溶液具有强氧化性和酸性,可与氨气反应生成盐,与硫化氢发生氧化还原反应,只有b、c不反应,故答案为:b、c;
(3)a.Na2SO3溶液与HNO3发生氧化还原反应生成NO,不生成B二氧化硫,故错误;
b.Na2SO3固体与浓硫酸发生复分解反应生成B,故正确;
c.固体硫在纯氧中燃烧,反应生成二氧化硫,但气体收集不易操作,故错误;
d.铜与浓H2SO4加热,发生氧化还原反应生成二氧化硫,故正确;
故答案为:b、d;
(4)将A通入到Na2S溶液中不能够证明A的氧化性,是因NO2和水反应生成的HNO3是一种氧化性酸,也能将Na2S氧化,使溶液变浑浊,
故答案为:否;NO2和水反应生成的HNO3是一种氧化性酸,也能将Na2S氧化,使溶液变浑浊.
点评:本题考查无机物的推断,为高频考点,侧重N、S及其化合物转化的考查,把握转化中发生的反应及物质的性质来推断物质为解答的关键,注意M、N是酸雨的主要成分及A为红棕色气体为推断的突破口,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
X、Y、Z、W是原子序数依次增大的短周期主族元素,原子半径大小关系为:W>Y>Z>X.X与W同主族,Z原子核外电子总数是其内层电子总数的4倍,且Z原子的核电荷数等于X、Y原子核电荷数之和.下列说法正确的是( )
| A、元素Z、W的简单离子的半径:Z<W |
| B、元素Y、Z分别对应的简单气态氢化物M、N,沸点M<N,热稳定性M>N |
| C、仅由X、Y、Z三种元素形成的化合物的水溶液可能呈酸性,也可能呈碱性 |
| D、1mol X2Z2与1mol W2Z2所含共价键数目相等 |
室温下,向10mL,pH=12的某碱溶液中加入10mL pH=2的盐酸,充分反应后滴入酚酞试液,溶液变红,则此碱一定是( )
| A、弱碱 | B、一元强碱 |
| C、多元强碱 | D、任何强碱 |
在下列各组溶液中,离子一定能大量共存的是( )
| A、0.1 mol/L NaClO溶液:Fe2+、K+、I-、Cl- | ||
| B、通入足量CO2后的溶液中:Na+、C6H5O-、CH3COO-、HCO3- | ||
| C、加入铝粉能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42- | ||
D、
|
NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、1molCu与足量的S反应转移电子数为2NA |
| B、1mol 1H含有的中子数为NA |
| C、常温常压下,1 mol氦气含有的核外电子数为2NA |
| D、标准状况下,2.24LH2O的质量是1.8g |

 元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y元素原子最外层电子数与核外电子总数之比为3:4,M元素原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体,据此回答下列问题:
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y元素原子最外层电子数与核外电子总数之比为3:4,M元素原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体,据此回答下列问题: