题目内容
9.设NA为阿伏伽德罗常数,下列说法正确的是( )| A. | 1molFeI2与足量的氯气反应时转移的电子数为2NA | |
| B. | 常温下,34gNH3含有6NA个N-H共价键 | |
| C. | 1molNa2O2中含有的离子总数为4NA | |
| D. | 标准状况下,16gCH4与22.4LH2O含有的电子数均为10NA |
分析 A、1molFeI2与足量的氯气反应时,亚铁离子变为+3价,碘离子变为0价;
B、求出氨气的物质的量,然后根据1mol氨气中含3molN-H 键来分析;
C、过氧化钠由2个钠离子和1个过氧根构成;
D、标况下水为液体.
解答 解:A、1molFeI2与足量的氯气反应时亚铁离子变为+3价,碘离子变为0价,故1molFeI2转移3NA个电子,故A错误;
B、34g氨气的物质的量为2mol,而1mol氨气中含3molN-H 键,故2mol氨气中含6NA条N-H键,故B正确;
C、过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠中含3NA个离子,故C错误;
D、标况下水为液体,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
19.在“绿色化学工艺”中,理想状态是原子利用率为100%.在用CH3C≡CH合成CH2=C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要的其它反应物有( )
| A. | CO和CH3OH | B. | CO2和H2O | C. | H2和CO2 | D. | CH3OH和H2 |
20.以下不能比较硫和磷非金属性相对强弱的是( )
| A. | 单质的活泼性 | B. | 氢化物的稳定性 | ||
| C. | H-S键和H-P键的极性 | D. | 最高氧化物对应水化物的酸性 |
17.在生产、保存、运输和使用浓硝酸时,下列说法不正确的是( )
| A. | 工业制取硝酸时生成的NO可循环使用 | |
| B. | 常温下,可选用铁制或铝制容器盛装 | |
| C. | 盛装容器的标签上应标注氧化剂和腐蚀品 | |
| D. | 使用时向96%的硝酸加水稀释可制得稀硝酸 |
4.下列说法不正确的是( )
| A. | 单晶硅是重要的半导体材料,可用于制造光导纤维 | |
| B. | 钠是一种强还原剂,可以将钛、铌等金属从其熔融的氧化物中置换出来 | |
| C. | 镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 | |
| D. | 铜能与氯化铁溶液反应,该反应可以应用于印刷电路板的制作 |
14.下列说法正确的是( )
| A. | 石墨和C60互为同位素 | |
| B. | CH3CH2OH和CH3OCH3互为同分异构体 | |
| C. | l4CO2的摩尔质量为46 | |
| D. | ${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为不同的核素,有不同的化学性质 |
11.如图所示,2个X分子反应生成一个Y分子和3个Z分子,下列判断不正确的( )
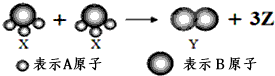

| A. | 该反应属于分解反应 | |
| B. | 该反应属于氧化还原反应 | |
| C. | X、Y、Z三种物质均属于非电解质 | |
| D. | 根据质量守恒定律可推知,1个Z分子含有两个A原子 |
12.以下实验或操作不能达到目的是( )
| A. | 用分液漏斗除去苯中的少量苯酚 | |
| B. | 用氨水鉴别Mg2+和Ag+ | |
| C. | 用水鉴别苯、乙醇、四氯化碳 | |
| D. | 用激光笔检验淀粉溶液和葡萄糖溶液 |

