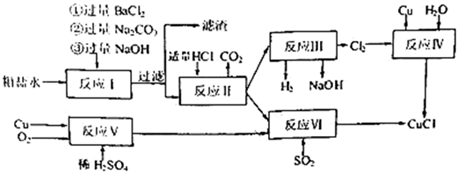
题目内容
12.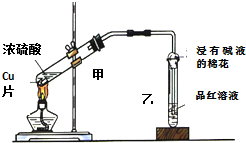 用如图装置做浓硫酸和铜反应的实验,实验过程中观察到甲试管底部有一些白色固体,乙试管中品红溶液褪色.
用如图装置做浓硫酸和铜反应的实验,实验过程中观察到甲试管底部有一些白色固体,乙试管中品红溶液褪色.(1)该白色固体是CuSO4(填化学式)
(2)浓硫酸在反应过程中除体现强氧化性以外,还体现了酸性
(3)下列有关实验的说法正确的是D
A.若将乙试管中品红溶液换成紫色石蕊试液,实验过程中可看到试液先变红后褪色
B.实验结束后,应先停止加热,后将乙处导管从溶液中取出
C.反应结束后,为检验白色固体成分,可直接向试管甲中加入适量水,通过溶液颜色变化来判断
D.浸有碱液的棉花的作用是吸收尾气,防止污染环境.
分析 (1)铜与浓硫酸反应生成硫酸铜,硫酸铜难溶于浓硫酸;
(2)反应生成硫酸铜和二氧化硫,硫元素的化合价降低;
(3)A.二氧化硫不能漂白石蕊试液;
B.应先停止加热,后将乙处导管从溶液中取出会发生倒吸;
C.不能直接向试管中加入适量水,浓硫酸剩余时加水放出大量的热可导致液滴飞溅;
D.二氧化硫是有毒气体,二氧化硫能被氢氧化钠溶液吸收.
解答 解:(1)在加热条件下铜与浓硫酸发生:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,反应生成的硫酸铜难溶于浓硫酸,所以白色固体是CuSO4;
故答案为:CuSO4;
(2)反应生成硫酸铜,表现了硫酸的酸性,生成二氧化硫,硫元素的化合价降低,体现了浓硫酸的氧化性;
故答案为:酸性;
(3)A.二氧化硫不能漂白石蕊试液,二氧化硫溶于水显酸性,能使石蕊试液变红色,但是不能褪色,故A错误;
B.应先停止加热,后将乙处导管从溶液中取出会发生倒吸,所以应该先将乙处导管从溶液中取出,再停止加热,故B错误;
C.不能直接向试管中加入适量水,浓硫酸剩余时加水放出大量的热可导致液滴飞溅,则取反应后的白色固体在烧杯中加水溶解观察是否变为蓝色,故C错误;
D.二氧化硫是有毒气体,二氧化硫能被氢氧化钠溶液吸收,所以浸有碱液的棉花的作用是吸收尾气,防止污染环境,故D正确.
故答案为:D.
点评 本题考查硫酸与铜反应的知识,题目难度不大,注意该反应的化学方程式以及二氧化硫的性质,为解答该题的重要问题,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
 源生产部分材料。
源生产部分材料。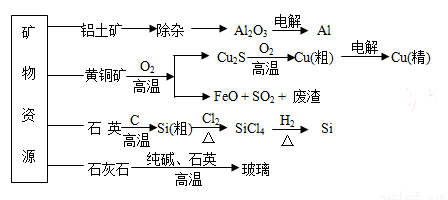
 ,FeO可用作冶炼铁的原料
,FeO可用作冶炼铁的原料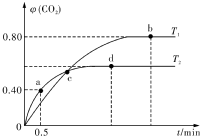 利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)═5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4molCO,测得CO2的体积分数随时间t变化曲线如图.请回答:
利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)═5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4molCO,测得CO2的体积分数随时间t变化曲线如图.请回答: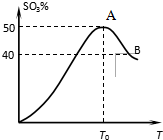 在体积为2L密闭 绝热容器中,将物质的量均为2.00mol的SO2、O2混合,发生如下反应:2SO2(g)+O2(g)?2SO3(g),容器中SO3的体积分数
在体积为2L密闭 绝热容器中,将物质的量均为2.00mol的SO2、O2混合,发生如下反应:2SO2(g)+O2(g)?2SO3(g),容器中SO3的体积分数