题目内容
15.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )| A. | 1.8g重水(D2O)中含NA个中子 | |
| B. | 8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA | |
| C. | 0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA | |
| D. | 标准状况下,密度为d g/L的某气体纯净物一个分子的质量为$\frac{22.4d}{{N}_{A}}$g |
分析 A、求出重水的物质的量,然后根据1mol重水中含10个中子;
B、二氧化锰只能与浓盐酸反应,和稀盐酸不反应;
C、NH4HSO4晶体由铵根离子和硫酸氢根构成;
D、先根据气体摩尔体积和密度计算出1mol该气体的质量,然后根据阿伏伽德罗常数计算出一个分子的质量;
解答 解:A、1.8g重水的物质的量为0.09mol,而1mol重水中含10个中子,故0.09mol重水中含0.9NA个,故A错误;
B、二氧化锰只能与浓盐酸反应,和稀盐酸不反应,故浓盐酸不能反应完全,则生成的氯气分子小于0.1NA个,故B错误;
C、NH4HSO4晶体由铵根离子和硫酸氢根构成,故0.5molNH4HSO4中不含氢离子,故C错误;
D、标况下,1mol该气体的体积约为22.4L,质量为22.4d,一个气体分子的质量为:$\frac{m}{{N}_{A}}$=$\frac{22.4d}{{N}_{A}}$g,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
3.化学与人类生产、生活密切相关,下列说法正确的是( )
| A. | 蚕丝和棉花的组成元素相同,结构不同,因而性质不同 | |
| B. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 | |
| C. | 鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排 | |
| D. | 微粒直径为2.5微米的细小颗粒物与空气形成的分散系属于胶体 |
10. 有A、B、C、D四种含14个电子的粒子,其结构特点如下:
有A、B、C、D四种含14个电子的粒子,其结构特点如下:
(1)某元素的原子核外电子数比A元素原子核外电子数多2,则该元素在周期表中的位置为第三周期第VIA族.工业上常以焦炭、A元素的氧化物为原料制取单质A,用化学方程式表示其原理SiO2+2C $\frac{\underline{\;高温\;}}{\;}$ Si+2CO↑.
(2)在101kPa,25℃时,42g B完全燃烧放出424.5kJ的热量,写出表示B的燃烧热的热化学方程式:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0 kJ/mol.
(3)32g 由D与钙离子组成的化合物中,含有的共用电子对数为9.03×1023.
(4)组成C的元素与另一短周期元素组成的分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间均以单键相连接.下列有关说法中错误的是C.
A.X原子为组成C的元素原子
B.该分子中,既含极性键,又含非极性键
C.Y原子可能为氢原子
D.从圆球的相对大小来分析,该分子可能为N2F4
(5)甲是组成C的元素最简单的气态氢化物.
①一定条件下,甲在恒容密闭容器中发生分解反应(正反应方向为吸热反应)并达平衡后,仅改变表中反应条件x,下列各项中y随x的增大而增大的是bc(填序号).
②甲与空气可以构成一种环保型燃料电池,电解质溶液是KOH,其负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
 有A、B、C、D四种含14个电子的粒子,其结构特点如下:
有A、B、C、D四种含14个电子的粒子,其结构特点如下:| 粒子代码 | A | B | C | D |
| 原子核数目 | 单核 | 不同元素构成的两核 | 同种元素构成的两核 | 同种元素构成的两核 |
| 粒子所带电荷数 | 0 | 0 | 0 | 两个负电荷 |
(2)在101kPa,25℃时,42g B完全燃烧放出424.5kJ的热量,写出表示B的燃烧热的热化学方程式:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0 kJ/mol.
(3)32g 由D与钙离子组成的化合物中,含有的共用电子对数为9.03×1023.
(4)组成C的元素与另一短周期元素组成的分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间均以单键相连接.下列有关说法中错误的是C.
A.X原子为组成C的元素原子
B.该分子中,既含极性键,又含非极性键
C.Y原子可能为氢原子
D.从圆球的相对大小来分析,该分子可能为N2F4
(5)甲是组成C的元素最简单的气态氢化物.
①一定条件下,甲在恒容密闭容器中发生分解反应(正反应方向为吸热反应)并达平衡后,仅改变表中反应条件x,下列各项中y随x的增大而增大的是bc(填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
20.下列实验中,所采取的操作方法、对应现象和结论均正确的是( )
| 选项 | 目的 | 操作 | 现象和结论 |
| A | 实验室制较纯净乙烯 | 将浓硫酸、乙醇混合液加热至170℃,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色,说明除去了SO2,得到纯净乙烯气体 |
| B | 检验淀粉的水解程度 | 向混合溶液中直接加入银氨溶液,加热 | 没有出现银镜,说明淀粉还没有水解 |
| C | 验证甲烷与氯气发生取代反应 | 将过量的氯气与甲烷混合,光照一段时间后滴入硝酸银溶液 | 有白色沉淀产生,证明发生取代反应 |
| D | 比较碳酸与醋酸的酸性强弱 | 用pH计测定0.1mol•L-1的碳酸氢钠和醋酸钠的pH值 | 碳酸氢钠溶液的pH大,证明碳酸的酸性比醋酸弱 |
| A. | A | B. | B | C. | C | D. | D |
7.下列关于化学实验的说法正确的是( )
| A. | 分离物质的量之比为1:6的氯化钠和硝酸钾混合物时,可先将样品溶解,然后加热至表面出现晶膜后冷却,过滤得到硝酸钾晶体;将母液加热至有大量晶体析出后,用余热蒸干,得氯化钠晶体 | |
| B. | 在“反应热的测量和计算”实验时须先将用于实验的等体积等物质的量的稀NaOH和稀HCl溶液置于相同温度(一般为25℃)下保温一段时间后再混合 | |
| C. | 在电化学实验中常使用碳电极,实验室一般采用多孔碳棒作为碳电极.有些电化学反应中的气体产物可以自由填充在多孔碳棒的疏松空隙中,从而降低反应池的极性,提高电流效率 | |
| D. | 在实验中观察到的物质的颜色可能会与其理论颜色有一定的偏差,如通过Cu和浓HNO3反应制得的Cu(NO3)2溶液中因溶有少量NO2而显黄色,苯酚因被空气中的O2氧化而显粉红色. |
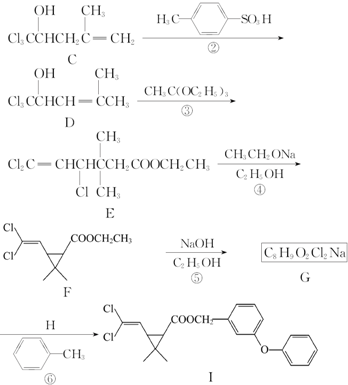
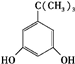 、
、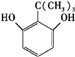 、
、 任意一种.
任意一种.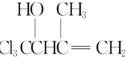 为原料合成
为原料合成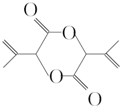 (用合成路线流程图表示,并注明反应条件).
(用合成路线流程图表示,并注明反应条件).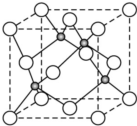 原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题: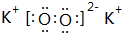 .
.