题目内容
5.根据下列实验操作和现象所得出的结论不正确的是( )| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中加入稀氢氧化钠溶液后,将湿润的红色试纸放在试管口 | 试纸没有变蓝色 | 溶液中不含NH4+ |
| B | 溴乙烷与NaOH溶液共热后,加HNO3酸化呈酸性,如AgNO3 | 出现淡黄色沉淀 | 溴乙烷发生了水解 |
| C | Mg(OH)2悬浊液中加入pH=7的醋酸氨溶液 | 沉淀溶解 | 加入醋酸发生NH4++OH-?NH3•H2O,使Mg(OH)2?Mg2++2OH-平衡向右移动 |
| D | 洁净的铁打在浓硝酸中浸泡片刻,蒸馏水冲洗后,再放入CuSO4溶液 | 铁定表面无红色物质生成 | 铁钉在浓硝酸中已钝化 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.加入稀氢氧化钠溶液,可能生成一水合氨;
B.水解生成NaBr,检验溴离子在酸性条件下;
C.Mg(OH)2悬浊液中加入pH=7的醋酸氨溶液,铵根离子式溶解平衡正向移动;
D.Fe与硫酸铜可发生置换反应,氧化铝不能,且常温下Fe遇能硝酸发生钝化.
解答 解:A.加入稀氢氧化钠溶液,可能生成一水合氨,则溶液中可能含NH4+,故A错误;
B.水解生成NaBr,检验溴离子在酸性条件下,则出现淡黄色沉淀,可知溴乙烷发生水解反应,故B正确;
C.Mg(OH)2悬浊液中加入pH=7的醋酸氨溶液,铵根离子式溶解平衡正向移动,则沉淀溶解,均合理,故C正确;
D.Fe与硫酸铜可发生置换反应,氧化铝不能,且常温下Fe遇能硝酸发生钝化,则铁定表面无红色物质生成,说明铁钉在浓硝酸中已钝化,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高考常见题型和高频考点,把握离子检验、有机物的性质、沉淀溶解平衡、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
16.下列根据实验现象得出的结论正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 废FeCl3蚀刻液中加入少量铁粉,振荡 | 得到澄清溶液 | 蚀刻液中一定不含Cu2+ |
| B | 将Fe(NO3)2样品溶于H2SO4,滴加KSCN溶液 | 溶液变红 | 稀硫酸能氧化Fe2+ |
| C | 向两份蛋白质溶液中分别滴加饱和硫酸钠溶液和硫酸铜溶液 | 均有固体析出 | 蛋白质均发生变性 |
| D | 葡萄糖溶液与新制Cu(OH)2混合加热 | 生成砖红色沉淀 | 葡萄糖分子中含有醛基 |
| A. | A | B. | B | C. | C | D. | D |
13.有机物甲、乙的结构如右图所示.下列说法错误的是( )


| A. | 甲、乙互为同分异构体 | |
| B. | 甲、乙都能发生取代、加成和水解反应 | |
| C. | 甲的一种同分异构体能发生银镜反应 | |
| D. | 等物质的量的甲和乙与足量的NaOH溶液反应,消耗NaOH的物质的量相等 |
20.油酸跟油脂(相对分子质量884)在体内代谢时可发生如下反应:C57H104O6(s)+80O2(g)═57CO2(g)+52H2O(l)已知燃烧1kg该化合物释放出热量3.8×104kJ.油酸甘油酯的燃烧热△H为( )
| A. | -3.4×104kJ•mol-1 | B. | 3.4×104kJ•mol-1 | ||
| C. | -3.8×104kJ•mol-1 | D. | 3.8×104kJ•mol-1 |
10.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | n(H2CO3)和c(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA | |
| B. | 5g 21H和31H的混合物发生热核聚变反应:21H+31H→42He+10n,净产生的中子(10n)数为NA | |
| C. | 1L 0.1mol/L乙醇溶液中存在的共价键总数为0.8NA | |
| D. | 56g 铁与足量氯气反应,氯气共得到3NA个电子 |
17.已知甲苯的结构简式为 ,其二氯代物的同分异构体有( )
,其二氯代物的同分异构体有( )
 ,其二氯代物的同分异构体有( )
,其二氯代物的同分异构体有( )| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
1.据科学家预测,月球的土壤中吸附着数百万吨的 3He,每百吨 3He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以 4He的形式存在.下列说法中正确的是( )
| A. | 4He原子核内含有4个质子 | |
| B. | 3He和4He互为同位素 | |
| C. | 3He原子核内含有3个中子 | |
| D. | 4He的最外层电子数为2,故4He具有较强的金属性 |
2.下列物质属于纯净物的是( )
| A. | 黄铜 | B. | 水玻璃 | C. | 氨水 | D. | 四氧化三铁 |
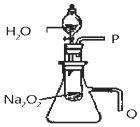 实验法是化学重要的研究物质性质的基本方法.某化学研究小组进行了如下实验,请回答问题.
实验法是化学重要的研究物质性质的基本方法.某化学研究小组进行了如下实验,请回答问题.