题目内容
13.有机物甲、乙的结构如右图所示.下列说法错误的是( )
| A. | 甲、乙互为同分异构体 | |
| B. | 甲、乙都能发生取代、加成和水解反应 | |
| C. | 甲的一种同分异构体能发生银镜反应 | |
| D. | 等物质的量的甲和乙与足量的NaOH溶液反应,消耗NaOH的物质的量相等 |
分析 甲、乙都含有碳碳双键,都可发生加成、加聚和氧化反应,甲含有羧基,具有酸性,可发生酯化反应,乙含有酯基,可发生水解反应,以此解答该题.
解答 解:A.甲、乙分子式相同,但结构不同,属于同分异构体,故A正确;
B.甲含有羧基,不能发生水解反应,故B错误;
C.甲的同分异构体中,如为甲酸对应的酯,含有醛基,可发生银镜反应,故C正确;
D.甲含有羧基,可与氢氧化钠发生中和反应,乙水解产物生成羧基,也可与氢氧化钠发生中和反应,则等物质的量的甲和乙与足量的NaOH溶液反应,消耗NaOH的物质的量相等,故D正确.
故选B.
点评 本题考查有机物的结构和性质,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层比内层多3个电子,Y、W同主族且W的质子数是Y的两倍,Z在短周期元素中金属性最强.下列说法正确的是( )
| A. | X的简单气态氢化物的热稳定性比Y的强 | |
| B. | W的氧化物的水化物的酸性一定比X的强 | |
| C. | 半径r(W)>r(Z)>r(Y)>r(X) | |
| D. | Z与Y形成的两种常见化合物中,阴、阳离子个数比均为1:2 |
4.将少量Cl2通入FeBr2的溶液中,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,这个事实说明Fe2+、Cl-、Br-三种粒子还原性由强到弱的排列顺序为:Fe2+>Br->Cl-.
1.下列说法正确的是( )
| A. | 将NaH溶于水,得到的水溶液能导电说明NaH是离子化合物 | |
| B. | Fe(OH)3胶体和Fe(OH)3沉淀的化学性质不相同 | |
| C. | 乙醇分子中含羟基,可与金属钠反应生成氢气 | |
| D. | MnO2具有较强氧化性,可作为H2 O2分解反应的氧化剂 |
8.某有机物分子式为C4H8,据此推测其结构和性质均正确的是( )
| A. | 它与乙烯一定是同系物 | |
| B. | 它一定能使溴水褪色 | |
| C. | 它的一氯代物可能只有一种 | |
| D. | 等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8 |
5.根据下列实验操作和现象所得出的结论不正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中加入稀氢氧化钠溶液后,将湿润的红色试纸放在试管口 | 试纸没有变蓝色 | 溶液中不含NH4+ |
| B | 溴乙烷与NaOH溶液共热后,加HNO3酸化呈酸性,如AgNO3 | 出现淡黄色沉淀 | 溴乙烷发生了水解 |
| C | Mg(OH)2悬浊液中加入pH=7的醋酸氨溶液 | 沉淀溶解 | 加入醋酸发生NH4++OH-?NH3•H2O,使Mg(OH)2?Mg2++2OH-平衡向右移动 |
| D | 洁净的铁打在浓硝酸中浸泡片刻,蒸馏水冲洗后,再放入CuSO4溶液 | 铁定表面无红色物质生成 | 铁钉在浓硝酸中已钝化 |
| A. | A | B. | B | C. | C | D. | D |
2.査阅文献可知:白磷:分子式为P4,白色固体,着火点40℃,剧毒;红磷:巨型共价分子,棕红色 固体,着火点240℃,毐性较低;黑磷:空间网状结构,它将有可能替代传统的单晶硅成为电子线路的基本材料.它们的结构如下图所示:

下列说法正确的是( )

下列说法正确的是( )
| A. | 属于同位素 | B. | 属于同分异构体 | ||
| C. | 都属于多原子分子 | D. | 黑磷在空气中不易燃烧 |
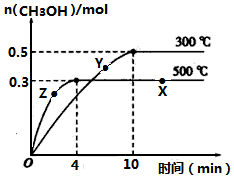 一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.


