题目内容
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图1装置(实验前已除尽装置内的空气)制取Na2S2O5.装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2═Na2S2O5.
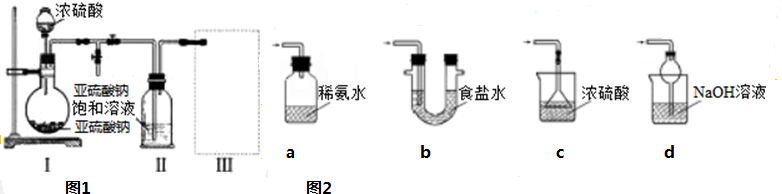
(1)a仪器的名称为: ,实验前要进行 .装置Ⅰ中产生气体的化学方程式为 .
(2)浓硫酸 (能或不能)用稀硫酸代替,原因是 .
(3)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 .
(4)装置Ⅲ用于处理尾气,可选用如图2的最合理装置(夹持仪器已略去)为 (填序号).
实验二 葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O═H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g?L-1.
②在上述实验过程中,若有部分HI被空气氧化,则测定结果 (填“偏高”“偏低”或“不变”).
实验一 焦亚硫酸钠的制取
采用如图1装置(实验前已除尽装置内的空气)制取Na2S2O5.装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2═Na2S2O5.

(1)a仪器的名称为:
(2)浓硫酸
(3)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是
(4)装置Ⅲ用于处理尾气,可选用如图2的最合理装置(夹持仪器已略去)为
实验二 葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O═H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
②在上述实验过程中,若有部分HI被空气氧化,则测定结果
考点:性质实验方案的设计,探究物质的组成或测量物质的含量
专题:实验设计题
分析:(1)a仪器的名称为分液漏斗,实验前首先进行气密性检查;装置I中浓硫酸与亚硫酸钠反应产生二氧化硫气体,同时生成硫酸钠和水;
(2)稀硫酸不能代替浓硫酸,与亚硫酸钠反应产生二氧化硫气体,因为二氧化硫易溶于水;
(3)装置Ⅱ中析出Na2S2O5晶体,通过过滤操作得到该晶体;
(4)处理过量的SO2尾气,既要吸收SO2尾气,同时能防倒吸;
(5)①根据反应“SO2+I2+2H2O=H2SO4+2HI”,则样品中抗氧化剂的残留量=
=0.16 g/L;
②若有部分HI被空气氧化又生成I2,导致消耗标准I2溶液的体积偏小,则测得结果偏低;
(2)稀硫酸不能代替浓硫酸,与亚硫酸钠反应产生二氧化硫气体,因为二氧化硫易溶于水;
(3)装置Ⅱ中析出Na2S2O5晶体,通过过滤操作得到该晶体;
(4)处理过量的SO2尾气,既要吸收SO2尾气,同时能防倒吸;
(5)①根据反应“SO2+I2+2H2O=H2SO4+2HI”,则样品中抗氧化剂的残留量=
| 0.01mol/L×0.025L×64g/mol |
| 0.1000L |
②若有部分HI被空气氧化又生成I2,导致消耗标准I2溶液的体积偏小,则测得结果偏低;
解答:
解:(1)a仪器的名称为分液漏斗,实验前首先进行气密性检查;装置I中浓硫酸与亚硫酸钠反应产生二氧化硫气体,同时生成硫酸钠和水,化学方程式:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
故答案为:分液漏斗、气密性检查、Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)稀硫酸不能代替浓硫酸,与亚硫酸钠反应产生二氧化硫气体,因为二氧化硫易溶于水,故不能用稀硫酸;
故答案为:不能、二氧化硫易溶于水,故不能用稀硫酸;
(3)装置Ⅱ中析出Na2S2O5晶体,通过过滤操作得到该晶体;
故答案为:过滤;
(4)处理过量的SO2尾气,a项装置瓶口封闭,错误;b项食盐水不能将大量的SO2尾气吸收,错误;c项漏斗口没入了液体中,错误,d项氢氧化钠溶液可吸收SO2尾气,同时能防倒吸,正确;
故答案为:d;
(5)①根据反应“SO2+I2+2H2O=H2SO4+2HI”,则样品中抗氧化剂的残留量=
=0.16 g/L;
故答案为:0.16 g/L;
②若有部分HI被空气氧化又生成I2,导致消耗标准I2溶液的体积偏小,则测得结果偏低;
故答案为:偏低.
故答案为:分液漏斗、气密性检查、Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)稀硫酸不能代替浓硫酸,与亚硫酸钠反应产生二氧化硫气体,因为二氧化硫易溶于水,故不能用稀硫酸;
故答案为:不能、二氧化硫易溶于水,故不能用稀硫酸;
(3)装置Ⅱ中析出Na2S2O5晶体,通过过滤操作得到该晶体;
故答案为:过滤;
(4)处理过量的SO2尾气,a项装置瓶口封闭,错误;b项食盐水不能将大量的SO2尾气吸收,错误;c项漏斗口没入了液体中,错误,d项氢氧化钠溶液可吸收SO2尾气,同时能防倒吸,正确;
故答案为:d;
(5)①根据反应“SO2+I2+2H2O=H2SO4+2HI”,则样品中抗氧化剂的残留量=
| 0.01mol/L×0.025L×64g/mol |
| 0.1000L |
故答案为:0.16 g/L;
②若有部分HI被空气氧化又生成I2,导致消耗标准I2溶液的体积偏小,则测得结果偏低;
故答案为:偏低.
点评:本题考查SO2的制取,Na2S2O5含量的测定,实验操作等基础知识,难度不大,掌握实验原理是解题的关键.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
 二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等.它的结构如下图所示,下列说法正确的是( )
二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等.它的结构如下图所示,下列说法正确的是( )| A、二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为离子键 |
B、1mol环戊二烯( )中含有σ键的数目为5NA )中含有σ键的数目为5NA |
| C、分子中存在π键 |
| D、Fe2+的电子排布式为1s22s22p63s23p63d44s2 |
学习化学使我们能运用化学知识解释日常生活中的现象,分析和解决生产生活中的实际问题.下列说法中你认为错误的是( )
| A、“雨后彩虹”“海市蜃楼”既是一种自然现象又是光学现象,还和胶体的知识有关 |
| B、从海水中提取食盐的过程,实际上就是蒸发海水、食盐晶体结晶析出的过程 |
| C、把大豆磨碎后,用水溶解其中的可溶性成分,经过滤后,分成豆浆和豆渣 |
| D、厨房中色拉油与凉开水混在一起,可采用过滤的方法进行分离 |
NA表示阿伏伽德罗常数,下列判断正确的是( )
| A、1 molCl2参加反应转移电子数一定为2NA | ||
| B、标准状况下,22.4L空气含有NA个单质分子 | ||
C、在36g
| ||
| D、0.5 mol?L-1AlCl3中含有Cl-数为1.5NA |
下列离子方程式正确的是( )
| A、H218O中投入Na2O2固体:2H218O+2Na2O2═4OH-+4Na++18O2↑ |
| B、过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| C、FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O |
| D、向氯化铝溶液中滴加过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |

