题目内容
相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气的物质的量之比为( )
| A、1:1 | B、1:6 |
| C、2:3 | D、3:2 |
考点:铝的化学性质,化学方程式的有关计算
专题:计算题
分析:铝与盐酸发生反应:2Al+6HCl=2AlCl3+3H2↑,铝与NaOH溶液发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,酸碱均足量,则等质量的Al均完全反应,结合反应方程式计算.
解答:
解:相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,酸、碱均足量时,Al完全反应,设Al的物质的量均为2mol,
由2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,
2molAl与足量酸、碱反应生成氢气均为3mol,
放出的氢气的物质的量之比为1:1,
故选A.
由2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,
2molAl与足量酸、碱反应生成氢气均为3mol,
放出的氢气的物质的量之比为1:1,
故选A.
点评:本题考查Al的化学性质及化学反应的计算,为高频考点,把握发生的反应及Al完全反应为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
卤代烃RCH2CH2X的化学键如图,则下列说法中正确的是( )
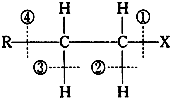

| A、当卤代烃发生水解反应时,被破坏的键是①和④ |
| B、当卤代烃发生水解反应时,被破坏的键是① |
| C、当卤代烃发生消去反应时,被破坏的键是①和③ |
| D、当卤代烃发生消去反应时,被破坏的键是①和② |
可用Zn+Br2═ZnBr2 设计成蓄电池,其中正极反应是( )
| A、Zn→Zn2++2e- |
| B、Br2+2e-→2Br- |
| C、2Br-→Br2+2e- |
| D、Zn2++2e-→Zn |
近几年流行喝苹果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(2-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为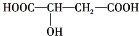 ,下列说法不正确的是( )
,下列说法不正确的是( )
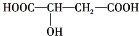 ,下列说法不正确的是( )
,下列说法不正确的是( )| A、苹果酸在一定条件下能发生酯化反应 |
| B、苹果酸在一定条件下能发生催化氧化反应 |
| C、1 mol苹果酸能与2 mol的Na发生反应 |
| D、1 mol苹果酸与Na2CO3溶液反应最多消耗3 mol Na2CO3 |
已知反应M+N→P+Q为放热反应.下列有关说法正确的是( )
| A、该反应不需加热即可发生 |
| B、N的能量一定高于Q |
| C、M的能量一定高于P |
| D、M和N的总能量一定高于P和Q的总能量 |
 如图甲所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光的地方,让混合气体缓慢地反应一段时间.试回答下列问题:
如图甲所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光的地方,让混合气体缓慢地反应一段时间.试回答下列问题: 熔融盐燃料电池具有高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池正极电极反应式为:O2+2CO2+4e-═2CO32-.试回答下列问题:
熔融盐燃料电池具有高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池正极电极反应式为:O2+2CO2+4e-═2CO32-.试回答下列问题: