题目内容
8.19克Na2CO3和NaHCO3的混合物与100mL,某浓度的稀盐酸溶液恰好反应,在标准状态下,生成4.48L的CO2气体,请计算:(1)混合物中Na2CO3的物质的量是多少?(2)盐酸溶液的物质的量浓度?分析 (1)NaHCO3盐酸的反应为:HCO3-+H+=CO2↑+H2O,碳酸钠与盐酸的反应为,CO32-+2H+=CO2↑+H2O,设混合物中Na2CO3和NaHCO3的物质的量分别为xmol、ymol,根据二者质量之和与二氧化碳的体积列方程计算x、y的值即可;
(2)恰好反应时溶质为氯化钠,则n(Na+)=n(HCl),结合碳酸钠、碳酸氢钠的物质的量可计算出氯化氢的物质的量,再根据c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:(1)Na2CO3和NaHCO3的混合物与盐酸反应的离子方程式分别为:CO32-+2H+=CO2↑+H2O、HCO3-+H+=CO2↑+H2O,
设混合物中含有Na2CO3和NaHCO3的物质的量分别为x、y,根据总质量及生成二氧化碳的量可得:
$\left\{\begin{array}{l}{106x+84y=19}\\{x+y=\frac{4.48L}{22.4L/mol}=0.2mol}\end{array}\right.$,解得:$\left\{\begin{array}{l}{x=0.1mol}\\{y=0.1mol}\end{array}\right.$,
即:混合物中含有0.1mol碳酸钠,
答:混合物中碳酸钠的物质的量为0.1mol;
(2)Na2CO3和NaHCO3的混合物与盐酸恰好反应后溶质为NaCl,则n(Na+)=n(HCl),
所以100mL该稀盐酸中含有氯化氢的物质的量为:0.1mol×2+0.1mol=0.3mol,
该稀盐酸的物质的量浓度为:c(HCl)=$\frac{0.3mol}{0.1L}$=3mol/L,
答:该稀盐酸的物质的量浓度为3mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确碳酸钠、碳酸氢钠与盐酸反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用方法.

| 选项 | 装置 | 操作与应用 |
| A |  | 在广口瓶中盛放蒸馏水,用于吸收在水中溶解度较小的气体 |
| B |  | 在广口瓶中盛放浓硫酸,左右导管中分别通入H2和N2,并按比例混合这两种气体 |
| C |  | 在广口瓶中盛放蒸馏水,用于测定易溶于水的气体的体积 |
| D |  | 在广口瓶中盛放蒸馏水,用于吸收易溶于水的气体 |
| A. | A | B. | B | C. | C | D. | D |

| A. | B为固体 n>1 | B. | B为液体 n>1 | C. | B为气体 n>1 | D. | B为气体 n<1 |
| A. | 常温常压下,16g由O2和O3组成的混合气体所含电子数8NA | |
| B. | 实验室分别用KClO3和H2O2制取3.2gO2时,转移的电子数均为0.4NA | |
| C. | 25℃时,1L PH=1的稀硫酸中约2NA个H+ | |
| D. | 标准状况下,22.4L SO3所含分子数NA |
| A. | FeCl3溶液的水解:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | 氯化钡溶液与碳酸钠溶液反应:Ba2++CO32-═BaCO3 | |
| C. | 硫化亚铁与盐酸反应:FeS+2H+═Fe2++H2S | |
| D. | 氯气通入碘化钾溶液中:Cl2+2I-═I2+2Cl- |
 (2-羟基-4-苯基丁酸乙酯)是制备某药物的中间体,常温下是一种无色透明的油状液体. 某兴趣小组以2-羟基-4-苯基丁酸和乙醇为原料设计实验制备该物质:
(2-羟基-4-苯基丁酸乙酯)是制备某药物的中间体,常温下是一种无色透明的油状液体. 某兴趣小组以2-羟基-4-苯基丁酸和乙醇为原料设计实验制备该物质:已知:
| 乙醇 | 2-羟基-4-苯基丁酸 | 2-羟基-4-苯基丁酸乙酯 | |
| 相对分子质量 | 46 | 180 | 208 |
| 状态 | 无色液体 | 白色固体 | 无色液体 |
| 沸点/℃ | 78.4 | 356.9 | 212 |
| 密度/g/cm3 | 0.789 | 1.219 | 1.075 |
| 溶解性 | 易溶于水、有机溶剂 | 能溶于水,易溶于有机溶剂 | 难溶于水,易溶于有机溶剂 |

实验步骤:
①按如图1装置连接仪器
②将18.00g 2-羟基-4-苯基丁酸加入三颈瓶中,加入20mL无水乙醇和适量浓硫酸,再加入几块沸石.
③加热至70℃左右保持恒温半小时.
④分离、提纯三颈瓶中粗产品,得到有机产品.
⑤精制产品,得到产品18.72g.
请回答下列问题:
(1)写出制备反应的化学方程式:
 .
.(2)加入原料时,能否最先加入浓硫酸?否.油水分离器的作用是及时分离产物水,促进平衡向生成酯的反应方向移动.
(3)本实验的加热方式宜用水浴加热.如果温度过高,或浓硫酸的量过多,制备产率会减小(填“增大”、“减小”或“不变”).
(4)分离提纯产品:取三颈瓶中混合物加入足量的饱和碳酸钠溶液,分液得到有机层.在本实验分离过程中,产物应该从分液漏斗的下口放出(填“上口倒出”或“下口放出”)
(5)产品精制:精制产品的实验装置如图2所示,试分析装置是否合理,不合理(填“合理”或“不合理”),若不合理将如何改进:温度计处在蒸馏烧瓶的支管口处,冷却水应从下口进上口出.(若装置合理,此空不作答).
(6)本实验得到产品的产率为90%.
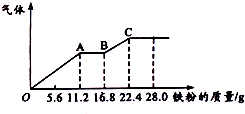 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的最随铁粉质量增加的变化如图所示,下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的最随铁粉质量增加的变化如图所示,下列分析或结果错误的是( )| A. | H2SO4浓度为5mol•L-1 | |
| B. | 第二份溶液中最终溶质为FeSO4 | |
| C. | 每份混合酸中NO3-物质的量为0.2mol | |
| D. | OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
 2,3-二甲基戊烷
2,3-二甲基戊烷

 C5H10.
C5H10.