题目内容
向一定压强的仪器中充入4LN2和H2的混合气体,反应后恢复到原温度,体积变为3.4L,容器内气体对相同条件下H2的相对密度为5.
(1)反应达到平衡时V(NH3)= L,反应前V(N2):V(H2)= ,N2的转化率为 .
(2)向平衡后的容器中再充入0.2molNH3,再达到平衡,测得吸收了6.44kJ的热量.
①从开始到重新平衡,混合气体对H2的相对密度变化为 ;
A、先增大后变小 B、先减小后增大C、一直减小D、一直不变
②写出合成氨的热化学方程式: .
(1)反应达到平衡时V(NH3)=
(2)向平衡后的容器中再充入0.2molNH3,再达到平衡,测得吸收了6.44kJ的热量.
①从开始到重新平衡,混合气体对H2的相对密度变化为
A、先增大后变小 B、先减小后增大C、一直减小D、一直不变
②写出合成氨的热化学方程式:
考点:化学平衡的计算
专题:
分析:(1)根据三段式列出起始、变化、平衡的量,根据平均相对分子质量的公式计算,进而求得体积比、平衡体积和转化率;
(2)①再加入0.2m0l氨气由于氨气摩尔质量为17,大于10,故混合气体摩尔质量增大,则混合气体密度增大,反应过程中,平衡逆向移动,向体积增大方向移动,故混合气体密度减小,平衡时由于与原平衡等效,所以混合气体密度和原平衡相等;
②从(1)计算可知,氮气的转化率为30%,则氨气分解率为70%,故0.2mol×70%氨气分解吸收6.44kJ热量,则2mol氨气分解吸收热量为:
=92kJ,则生成2mol氨气放出92kJ热量,据此写出热化学方程式.
(2)①再加入0.2m0l氨气由于氨气摩尔质量为17,大于10,故混合气体摩尔质量增大,则混合气体密度增大,反应过程中,平衡逆向移动,向体积增大方向移动,故混合气体密度减小,平衡时由于与原平衡等效,所以混合气体密度和原平衡相等;
②从(1)计算可知,氮气的转化率为30%,则氨气分解率为70%,故0.2mol×70%氨气分解吸收6.44kJ热量,则2mol氨气分解吸收热量为:
| 6.44KJ |
| 0.14mol |
解答:
解:(1)设起始时氮气的体积为x,氢气的体积为4-x,
3H2 +N2 ?2NH3,体积变化
3 1 2 2
起始 4-x x 0 0
变化 0.9 0.3 0.6 4-3.4=0.6
平衡 4-x-0.9 x-0.3 0.6 0.6
容器内气体对相同条件的氢气的相对密度为5,则相对分子质量为5×2=10,
×2+
+
=10,解得x=1
反应前混合气体中V(N2):V(H2)=x:(4-x)=1:(4-1)=1:3;
平衡后氨气体积为:0.6L,氮气的转化率为:
×100%=30%,
故答案为:0.6;1:3;30%;
(2)①再加入0.2m0l氨气由于氨气摩尔质量为17,大于10,故混合气体摩尔质量增大,则混合气体密度增大,反应过程中,平衡逆向移动,向体积增大方向移动,故混合气体密度减小,平衡时由于与原平衡等效,所以混合气体密度和原平衡相等,从开始到重新平衡,混合气体对H2的相对密度变化先增大后变小;
故答案为:A;
②从(1)计算可知,氮气的转化率为30%,则氨气分解率为70%,故0.2mol×70%氨气分解吸收6.44kJ热量,则2mol氨气分解吸收热量为:
=92kJ,则生成2mol氨气放出92kJ热量,则氢气和氮气合成氨气的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92KJ/mol,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92KJ/mol.
3H2 +N2 ?2NH3,体积变化
3 1 2 2
起始 4-x x 0 0
变化 0.9 0.3 0.6 4-3.4=0.6
平衡 4-x-0.9 x-0.3 0.6 0.6
容器内气体对相同条件的氢气的相对密度为5,则相对分子质量为5×2=10,
| 3.1-x |
| 3.4 |
| x-0.3 |
| 3.4 |
| 0.6 |
| 3.4 |
反应前混合气体中V(N2):V(H2)=x:(4-x)=1:(4-1)=1:3;
平衡后氨气体积为:0.6L,氮气的转化率为:
| 0.3L |
| 1L |
故答案为:0.6;1:3;30%;
(2)①再加入0.2m0l氨气由于氨气摩尔质量为17,大于10,故混合气体摩尔质量增大,则混合气体密度增大,反应过程中,平衡逆向移动,向体积增大方向移动,故混合气体密度减小,平衡时由于与原平衡等效,所以混合气体密度和原平衡相等,从开始到重新平衡,混合气体对H2的相对密度变化先增大后变小;
故答案为:A;
②从(1)计算可知,氮气的转化率为30%,则氨气分解率为70%,故0.2mol×70%氨气分解吸收6.44kJ热量,则2mol氨气分解吸收热量为:
| 6.44KJ |
| 0.14mol |
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92KJ/mol.
点评:本题考查了化学平衡的有关计算,热化学方程式的书写,影响化学平衡因素的分析应用等,难度中等.注意热化学方程式的计算应用.

练习册系列答案
相关题目
下列各组中的离子能在pH=1的无色溶液中大量共存的是( )
| A、Ba2+、Na+、I-、ClO- |
| B、Mg2+、Cl-、Al3+、NO3- |
| C、K+、Fe2+、Cl-、MnO4- |
| D、Ca2+、Na+、Fe3+、Br- |
下列每组中各有三对物质,他们都能用分液漏斗分离的是( )
| A、乙酸乙酯和水,酒精和水,植物油和水 |
| B、四氯化碳和水,溴苯和水,硝基苯和水 |
| C、甘油和水,乙酸和水,乙酸和乙醇 |
| D、酒精和水,苯和水,己烷和水 |
取某一元醇12.5g,跟乙酸混合后,加入浓硫酸并加热,若反应完毕时,制得某酯11.17g,又回收该一元醇4.3g,则该一元醇为( )
| A、C5H11OH |
| B、C6H13OH |
| C、C7H15OH |
| D、C8H17OH |
下列各组物质能相互反应得到氢氧化铝的是( )
| A、铝与氢氧化钠溶液 |
| B、硝酸铝与过量的氢氧化钠溶液 |
| C、氧化铝与热水 |
| D、硫酸铝溶液与过量的氨水 |

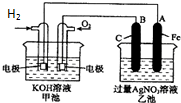 如图是一个化学过程的示意图.已知甲池的总反应式为:2H2+O2═2H2O
如图是一个化学过程的示意图.已知甲池的总反应式为:2H2+O2═2H2O
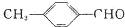 中的含氧官能团,请写出该反应的化学方程式:
中的含氧官能团,请写出该反应的化学方程式: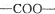 结构的基团
结构的基团