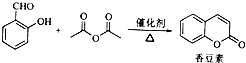
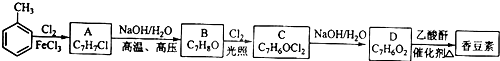
题目内容
在CoCl2溶液中存在如下平衡:[CoCl4]2-+6H2O?[Co(H2O)6]2++4Cl-△H<0(由蓝色变粉红色)下列说法中不正确的是( )
| A、升高温度,溶液颜色由蓝色变为粉红色 |
| B、将CoCl2固体溶于大量水中得到粉红色溶液 |
| C、若用 CoCl2固体作空气湿度指示剂,则湿度增大时,颜色由蓝色变为粉红色 |
| D、将CoCl2溶于浓盐酸,可得到蓝色溶液 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:钴元素在水溶液里以Co(H2O)6]2+存在,根据Co(H2O)6]2+的颜色判断氯化钴溶液颜色,[CoCl4]2-、[Co(H2O)6]2+都是配合物离子,向氯化钴溶液中加入含有氯离子的物质能抑制氯化钴和水反应,据此分析解答.
解答:
解:A.因为反应放热,所以升高温度,平衡向逆反应方向移动,溶液颜色由粉红色变为蓝色,故A错误;
B.钴元素在水溶液里以Co(H2O)6]2+存在,Co(H2O)6]2+呈粉红色,所以氯化钴溶液呈粉红色,故B正确;
C.若用 CoCl2固体作空气湿度指示剂,则湿度增大时,与水反应生成Co(H2O)6]2+颜色由蓝色变为粉红色,故C正确;
D.将氯化钴溶于浓盐酸,溶液中氯离子浓度增大,平衡向逆反应方向移动,钴元素在水溶液里以[CoCl4]2-存在,所以其溶液呈蓝色,故D正确;
故选A.
B.钴元素在水溶液里以Co(H2O)6]2+存在,Co(H2O)6]2+呈粉红色,所以氯化钴溶液呈粉红色,故B正确;
C.若用 CoCl2固体作空气湿度指示剂,则湿度增大时,与水反应生成Co(H2O)6]2+颜色由蓝色变为粉红色,故C正确;
D.将氯化钴溶于浓盐酸,溶液中氯离子浓度增大,平衡向逆反应方向移动,钴元素在水溶液里以[CoCl4]2-存在,所以其溶液呈蓝色,故D正确;
故选A.
点评:本题考查化学平衡的移动,明确平衡移动原理是解本题关键,根据平衡的移动方向判断溶液颜色即可,难度不大.

练习册系列答案
相关题目
下列混和物可用分液漏斗分离的是( )
| A、苯和溴苯 |
| B、乙酸乙酯与碳酸钠溶液 |
| C、乙醇和水 |
| D、溴和四氯化碳 |
共价键的断裂有均裂和异裂两种方式.即:A:B→A?+B?,均裂; A:B→A++[:B]-,异裂.
下列化学方程式中发生共价键均裂的是( )
下列化学方程式中发生共价键均裂的是( )
| A、2K+2H2O=2KOH+H2↑ | |||
| B、2Na+2C2H5OH→2C2H5ONa+H2↑ | |||
| C、Na2CO3+H2O=NaHCO3+NaOH | |||
D、CH3COOH+CH3CH2OH
|