题目内容
A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)A为 (写出元素符号,下同),电子排布式是 ;
(2)B为 ,简化电子排布式是 ;
(3)C为 ,价电子排布式是 ;
(4)D为 ,电子排布图是 ;
(5)E为 ,原子结构示意图是 .
 ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:(1)A为
(2)B为
(3)C为
(4)D为
(5)E为
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:A、B、C、D是四种短周期元素,A的原子结构示意图为: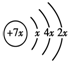 ,x=2,故A为Si元素,A、B、C同周期,即处于第三周期,B是同周期除稀有气体外半径最大的元素,B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素,E是过渡元素,其原子外围电子排布式为3d64s2,故E为Fe元素.
,x=2,故A为Si元素,A、B、C同周期,即处于第三周期,B是同周期除稀有气体外半径最大的元素,B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素,E是过渡元素,其原子外围电子排布式为3d64s2,故E为Fe元素.
 ,x=2,故A为Si元素,A、B、C同周期,即处于第三周期,B是同周期除稀有气体外半径最大的元素,B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素,E是过渡元素,其原子外围电子排布式为3d64s2,故E为Fe元素.
,x=2,故A为Si元素,A、B、C同周期,即处于第三周期,B是同周期除稀有气体外半径最大的元素,B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素,E是过渡元素,其原子外围电子排布式为3d64s2,故E为Fe元素.解答:
解:A、B、C、D是四种短周期元素,A的原子结构示意图为: ,x=2,故A为Si元素,A、B、C同周期,即处于第三周期,B是同周期除稀有气体外半径最大的元素,B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素,E是过渡元素,其原子外围电子排布式为3d64s2,故E为Fe元素,则:
,x=2,故A为Si元素,A、B、C同周期,即处于第三周期,B是同周期除稀有气体外半径最大的元素,B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素,E是过渡元素,其原子外围电子排布式为3d64s2,故E为Fe元素,则:
(1)A为Si元素,原子核外电子数为14,原子电子排布式是:1s22s22p63s23p2,
故答案为:Si;1s22s22p63s23p2;
(2)B为Na元素,原子核外电子数为11,简化电子排布式是:[Ne]3s1,
故答案为:Na;[Ne]3s1;
(3)C为P元素,最外层电子数为5,价电子排布式为3s23p3,
故答案为:P;3s23p3;
(4)D为N元素,原子核外电子数为7,其电电子排布图为: ,
,
故答案为:N; ;
;
(5)E为Fe元素,是26号元素,Fe原子结构示意图是: ,
,
故答案为:Fe; .
.
 ,x=2,故A为Si元素,A、B、C同周期,即处于第三周期,B是同周期除稀有气体外半径最大的元素,B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素,E是过渡元素,其原子外围电子排布式为3d64s2,故E为Fe元素,则:
,x=2,故A为Si元素,A、B、C同周期,即处于第三周期,B是同周期除稀有气体外半径最大的元素,B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素,E是过渡元素,其原子外围电子排布式为3d64s2,故E为Fe元素,则:(1)A为Si元素,原子核外电子数为14,原子电子排布式是:1s22s22p63s23p2,
故答案为:Si;1s22s22p63s23p2;
(2)B为Na元素,原子核外电子数为11,简化电子排布式是:[Ne]3s1,
故答案为:Na;[Ne]3s1;
(3)C为P元素,最外层电子数为5,价电子排布式为3s23p3,
故答案为:P;3s23p3;
(4)D为N元素,原子核外电子数为7,其电电子排布图为:
 ,
,故答案为:N;
 ;
;(5)E为Fe元素,是26号元素,Fe原子结构示意图是:
 ,
,故答案为:Fe;
 .
.
点评:本题考查结构性质与位置关系、核外电子排布规律等,难度中等,推断元素是解题的关键,侧重对核外电子排布规律的考查.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案
相关题目
根据主族元素的原子序数不能确定的是( )
| A、质子数 | B、中子数 |
| C、核外电子数 | D、核电荷数 |
在下列反应中,HNO3既表现出氧化性,又表现出酸性的是( )
| A、H2S+2HNO3═S↓+2NO2↑+2H2O | ||||
| B、3FeO+10HNO3═3Fe(NO3)3+5H2O+NO↑ | ||||
C、4HNO3
| ||||
| D、3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O |

 X、Y代表两组概念,其关系如下图,下列选项不满足相应关系的是( )
X、Y代表两组概念,其关系如下图,下列选项不满足相应关系的是( )