题目内容
4. Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.
Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.【实验步骤】
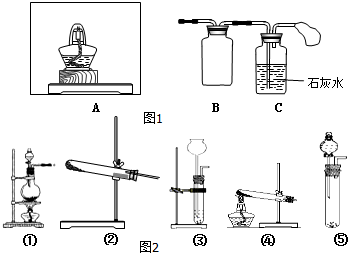
Ⅰ.按图1所示装置(部分仪器未画出)组装仪器,并检查装置气密性.
Ⅱ.将0.6g炭粉与3.9g Na2O2均匀混合,装入A装置中的反应容器,在靠近反应容器口处放置一张湿润的氯化钯试纸(湿润氯化钯试纸遇CO变黑,可用于检验是否有CO生成).
Ⅲ.用酒精灯微微加热A装置中的反应容器.
【实验现象】
A装置中发生剧烈反应并产生火花,氯化钯试纸未变黑,石灰水未变浑浊.
请回答:
(1)在A装置中方框内的仪器(图2)可以选用②,(从①②③④⑤中选出所需要的装置,使仪器装置图完整)
(2)装置B的作用是防止倒吸
(3)通过探究发现,装置A中发生的反应为2Na2O2+C═Na2CO3+X,X物质的化学式是Na2O.
(4)CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯(Pd),同时生成另外两种新物质.已知反应过程中转移6.02×1023个电子时,生成53g Pd,该反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl.
(5)将装置A中充分反应后所得产物溶于适量水中.
①所得溶液的溶质是NaOH、Na2CO3(填化学式).
②常温,若使所得溶液与100mL稀盐酸恰好完全反应至溶液pH=7,该盐酸的物质的量浓度为1 mol/L.
(6)写出Na2O2的一种重要用途用于呼吸面具中作为O2的来源.
分析 (1)根据A的作用是:炭粉与Na2O2均匀混合,装入A装置中作为反应容器,据此选择仪器;
(2)B为安全瓶,据此确定作用;
(3)依据原子个数守恒判断X;
(4)n(Pd)=$\frac{53g}{106g/mol}$=0.5mol,转移电子的物质的量为1mol,反应为为PdCl2、CO和H2O,生成物应为CO2和HCl;
(5)①将装置A中充分反应后所得产物溶于适量水中,得到碳酸钠和氢氧化钠;
②NaOH、Na2CO3与HCl反应的产物是氯化钠溶液,根据n(Cl-)=n(Na+)来计算回答.
(6)过氧化钠可以和水以及二氧化碳反应生成氧气,据此回答其应用.
解答 解:(1)炭粉与Na2O2均匀混合,装入A装置中作为反应容器,装置A应该是能盛放固体来加热的反应容器,②符合,
故答案为:②;
(2)B为安全瓶,可防止倒吸,故答案为:防止倒吸;
(3)2Na2O2+C$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+X,由原子个数守恒,可知X中含有2个钠原子1个氧原子,所以X为Na2O,故答案为:Na2O;
(4)n(Pd)=$\frac{53g}{106g/mol}$=0.5mol,转移电子的物质的量为1mol,反应为为PdCl2、CO和H2O,生成物应为CO2和HCl,则反应的方程式为PdCl2+CO+H2O=Pd+CO2+2HCl,
故答案为:PdCl2+CO+H2O=Pd+CO2+2HCl;
(5)①将装置A中充分反应后所得产物:Na2CO3、Na2O溶于适量水中,得到碳酸钠和氢氧化钠,故答案为:NaOH、Na2CO3;
②3.9g Na2O2 0.1mol,的物质的量是0.05mol,钠离子若使所得溶液NaOH、Na2CO3与100mL稀盐酸恰好完全反应,至溶液pH=7,产物是氯化钠溶液,n(Cl-)=n(Na+)=n(HCl)=0.1mol,该盐酸的物质的量浓度为$\frac{0.1mol}{0.1L}$=1mol/L,故答案为:1 mol/L;
(6)过氧化钠可以和水以及二氧化碳反应生成氧气,所以过氧化钠可以做呼吸面具中O2的来源,故答案为:用于呼吸面具中作为O2的来源.
点评 本题为实验探究题,题目难度中等,把握实验基本操作方法和物质的性质是解题关键,注意根据反应的现象判断反应原理.

| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
| B | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧 | CO2、H2O与Na2O2反应是放热反应 |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该溶液中一定含有CO32- |
| D | 用铂丝蘸取某溶液在无色火焰上灼烧直接观察火焰颜色未见紫色 | 原溶液中不含K+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 含大量OH-的溶液:Ba2+、K+、NO3-、AlO2- | |
| B. | 加人Na2O2粉末的溶液:Na+、Cl-、SO32-、OH- | |
| C. | c(KNO3)=1.0mol/L的溶液:H+、I-、Cl-、Ca2+ | |
| D. | 滴入紫色石蕊试液呈蓝色的溶液:Fe3+、Ba2+、HCO3-、Br- |
| A. | 氢元素是还原剂 | B. | O2是氧化剂 | C. | H2发生氧化反应 | D. | O2被还原 |
| A. | D>C>B>A | B. | B>C>D>A | C. | D>B>C>A | D. | C>D>A>B |
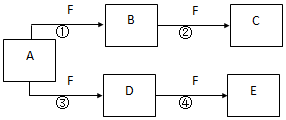 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,D的钠盐是一种致癌物质,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.回答下列问题:
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,D的钠盐是一种致癌物质,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.回答下列问题: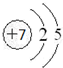 ,A的电子式为
,A的电子式为 ,
,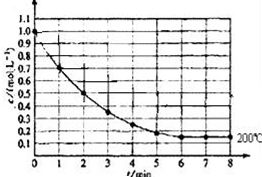 一固定体积的密闭容器中放入1molX(g)发生反应:X(g)?4Y(s)+Z(g),如图表示在 200℃时,X的浓度随时间变化的曲线.
一固定体积的密闭容器中放入1molX(g)发生反应:X(g)?4Y(s)+Z(g),如图表示在 200℃时,X的浓度随时间变化的曲线.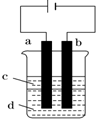 有H、O、N、Na四种元素:
有H、O、N、Na四种元素: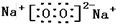 ;由两种元素组成的既有极性键又有非极性共价键物质的结构式是(写一种)H-O-O-H;
;由两种元素组成的既有极性键又有非极性共价键物质的结构式是(写一种)H-O-O-H;