题目内容
14.下列有关物质分离或提纯的方法错误的选项是( )| 选项 | 物质 | 杂质 | 主要操作方法 |
| A | 溴苯 | 苯 | 加入铁粉和溴,过滤 |
| B | 氯化钠 | 氯化铵 | 加热 |
| C | 正丁醇,沸点117.7℃ | 乙醚,沸点34.5℃ | 蒸馏 |
| D | 乙酸乙酯 | 乙酸 | 加入饱和碳酸钠溶液,分液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.加入溴,易引入新杂质;
B.氯化铵不稳定,加热易分解;
C.二者沸点不同,可蒸馏分离;
D.乙酸乙酯不溶于饱和碳酸钠溶液.
解答 解:A.溴易溶于溴苯,易引入新杂质,可直接蒸馏分离,故A错误;
B.氯化铵不稳定,加热易分解,可加热除杂,故B正确;
C.二者沸点不同,可蒸馏分离,故C正确;
D.乙酸乙酯不溶于饱和碳酸钠溶液,乙酸与碳酸钠反应,可分离,故D正确.
故选A.
点评 本题考查物质的分离、提纯,为高频考点,综合考查学生的实验能力,注意除杂时不能引入新的杂质,题目难度不大,注意相关物质的性质.

练习册系列答案
相关题目
4.A、B、C、D是原子序数依次增大的不同主族短周期元素,其中两种为金属元素,A原子的最外层电子数与次外层电子数相等,A与D、B与C这两对原子的最外层电子数之和均为9.下列说法正确的是( )
| A. | 固体B2C3不能从溶液中制得 | |
| B. | C的氧化物对应水化物为强酸 | |
| C. | B的简单离子半径大于D的简单离子半径 | |
| D. | AD2分子中各原子最外层都达到8电子稳定结构 |
5.下列关于化学用语的表示正确的是( )
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{10}$O | |
| B. | 氯离子的结构示意图: | |
| C. | 对苯二甲酸的结构简式: | |
| D. | NaHCO3在水溶液中的电离方程式:NaHCO3=Na++HCO3- |
2.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=2的溶液中:K+、Mg2+、I-、S2- | |
| B. | Br-不能大量存在的溶液中:Fe2+、Ca2+、Cl-、NO3- | |
| C. | c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、NO3-、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Mg2+、NH4+、SCN-、SO42- |
9.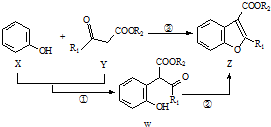 如图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述错误的是( )
如图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述错误的是( )
 如图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述错误的是( )
如图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述错误的是( )| A. | 反应①属于加成反应 | |
| B. | W能发生加成、水解、氧化反应 | |
| C. | X在一定条件下可发生缩聚反应 | |
| D. | 一定条件下Z与足量H2反应后所得产物中至少含有4个手性碳原子 |
3.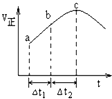 向某恒容密闭容器中通入N2和H2,在500℃时,使反应:N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向某恒容密闭容器中通入N2和H2,在500℃时,使反应:N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
 向某恒容密闭容器中通入N2和H2,在500℃时,使反应:N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向某恒容密闭容器中通入N2和H2,在500℃时,使反应:N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A. | 反应在c点达到平衡状态 | |
| B. | △t1=△t2时,N2的转化量:a~b段小于b~c段 | |
| C. | C点反应放出的热量达到最大 | |
| D. | 反应物浓度:a点小于b点 |
20. SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.
SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.
Ⅰ.一种制备SOCl2的常用方法是:SO3+SCl2=SOCl2+SO2,其模拟装置如图所示(夹持装置略去),各物质的部分性质如下:
(1)A装置是由水槽、温度计、蒸馏烧瓶和分液漏斗组装而成的,当蒸馏烧瓶中反应物出现
樱桃红色变为无色现象时,说明反应完成,停止滴加SO3.
(2)B中所盛药品是浓硫酸,装置C中药品及选择该药品的作用分别是氢氧化钠、吸收尾气.
(3)反应后将A中混合物进行蒸馏,收集到较纯净的产品,需控制蒸馏温度在C左右.
a.44.8℃b.59℃c.76℃
Ⅱ.Li-SOCl2电池是一种优质高效的电池,常放在心脏起搏器中,电池的总反应可表示为4Li+2SOCl2=4LiCl+S+SO2,回答下列问题:
(4)电池正极发生的电极反应为2SOCl2+4Li++4e-=4LiCl+S+SO2.
(5)该电池必须在惰性环境中组装,原因是锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应.
(6)若含金属锂6.9g的电池质量为m g,平均电压为n V,则该电池的比能量为$\frac{2.68×1{0}^{4}n}{m}$W•h•kg-1(用含有m、n的代数式,系数用科学计数法表示,结果保留三个有效数字:比能量=$\frac{电池输出电能}{电池质量}$,1W•h=3.6×103J,法拉第常数F=96500c•mol-1).
 SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.
SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.Ⅰ.一种制备SOCl2的常用方法是:SO3+SCl2=SOCl2+SO2,其模拟装置如图所示(夹持装置略去),各物质的部分性质如下:
| SO3 | SCl2 | SOCl2 | SO2 | |
| 熔点 | 16.8℃ | -122℃ | -104.5℃ | -75.5℃ |
| 沸点 | 44.8℃ | 59℃ | 76℃ | -10℃ |
| 颜色 | 无色 | 樱桃红色 | 无色 | 无色 |
| 备注 | 不稳定 | 不稳定,沸点以上分解 |
樱桃红色变为无色现象时,说明反应完成,停止滴加SO3.
(2)B中所盛药品是浓硫酸,装置C中药品及选择该药品的作用分别是氢氧化钠、吸收尾气.
(3)反应后将A中混合物进行蒸馏,收集到较纯净的产品,需控制蒸馏温度在C左右.
a.44.8℃b.59℃c.76℃
Ⅱ.Li-SOCl2电池是一种优质高效的电池,常放在心脏起搏器中,电池的总反应可表示为4Li+2SOCl2=4LiCl+S+SO2,回答下列问题:
(4)电池正极发生的电极反应为2SOCl2+4Li++4e-=4LiCl+S+SO2.
(5)该电池必须在惰性环境中组装,原因是锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应.
(6)若含金属锂6.9g的电池质量为m g,平均电压为n V,则该电池的比能量为$\frac{2.68×1{0}^{4}n}{m}$W•h•kg-1(用含有m、n的代数式,系数用科学计数法表示,结果保留三个有效数字:比能量=$\frac{电池输出电能}{电池质量}$,1W•h=3.6×103J,法拉第常数F=96500c•mol-1).