题目内容
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.

(1)根据表中数据,在上图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(2)体系中发生反应的化学方程式是
(3)该反应在0-3min时间内产物Z的平均反应速率:
(4)该反应达到平衡时反应物X的转化率α等于 ;
(5)改变下列反应条件,该反应的反应速率将如何改变?(填“增大”、“减小”或“不变”)
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

(1)根据表中数据,在上图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(2)体系中发生反应的化学方程式是
(3)该反应在0-3min时间内产物Z的平均反应速率:
(4)该反应达到平衡时反应物X的转化率α等于
(5)改变下列反应条件,该反应的反应速率将如何改变?(填“增大”、“减小”或“不变”)
| 改变的反应条件 | 反应速率改变的结果 |
| 降低反应体系的温度 | |
| 将容器的体积改为1L | |
| 使用催化剂 | |
| 保持容器体积不变,充入一定量氦气,增大压强 |
考点:物质的量或浓度随时间的变化曲线,化学反应速率的影响因素,化学平衡的计算
专题:化学平衡专题,化学反应速率专题
分析:(1)由表中数据可知,开始时的物质的量为1mol,故X、Y的起始浓度为
=0.5mol/L,Z的起始浓度为0,7min时反应到达平衡,平衡时X的物质的量为0.55mol,故X的平衡浓度为
=0.275mol/L,平衡时Z的物质的量为0.45mol,故Z的平衡浓度为
=0.225mol/L,据此作图;
(2)根据参加反应的物质的量之比等于计量数之比书写方程式;
(3)根据表中数据求出0-3min时间内产物Z的浓度变化,再求出反应速率;
(4)根据表中数据求出到达平衡时转化的X的物质的量,再求出转化率;
(5)根据温度、压强、催化剂对反应速率的影响分析.
| 1mol |
| 2L |
| 0.55mol |
| 2L |
| 0.45mol |
| 2L |
(2)根据参加反应的物质的量之比等于计量数之比书写方程式;
(3)根据表中数据求出0-3min时间内产物Z的浓度变化,再求出反应速率;
(4)根据表中数据求出到达平衡时转化的X的物质的量,再求出转化率;
(5)根据温度、压强、催化剂对反应速率的影响分析.
解答:
解:(1)由表中数据可知,开始时的物质的量为1mol,故X、Y的起始浓度为
=0.5mol/L,Z的起始浓度为0,7min时反应到达平衡,平衡时X的物质的量为0.55mol,故X的平衡浓度为
=0.275mol/L,平衡时Z的物质的量为0.45mol,故Z的平衡浓度为
=0.225mol/L,以横坐标为时间,从坐标为X、Z的物质的量(n),
根据以上数据作图: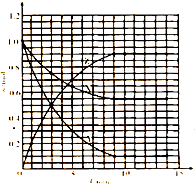 ,
,
故答案为: ;
;
(2)由表中数据看出反应从开始到平衡,X的物质的量减小,应为反应物,0~9min物质的量变化值为1.00mol-0.55mol=0.45mol,
Y的物质的量减小,应为反应物,0~9min物质的量变化值为1.00mol-0.10mol=0.90mol,
Z的物质的量增多,应为是生成物,物质的量的变化值为0.90mol,
根据物质的量的变化与化学计量数呈正比,则n(X):n(Y):n(Z)=0.45mol:0.90mol:0.90mol=1:2:2,则反应方程为:X+2Y?2Z;
故答案为:X+2Y?2Z;
(3)0-3min时间内产物Z的平均反应速率为:
=0.083 mol?L-1?min-1,故答案为:0.083 mol?L-1?min-1;
(4)到达平衡时剩余的X为0.55mol,则转化的X为1mol-0.55mol=0.45mol,所以X的转化率α=
×100%=45%,
故答案为:45%;
(5)A.降低温度,反应物中活化分子百分数减小,有效碰撞几率减小,所以反应速率减小;
B.将容器的体积改为1L,则容器的体积缩小,反应物的浓度增大,反应物中活化分子数目增大,有效碰撞几率增大,所以速率增大;
C.使用催化剂能降低反应所需活化能,反应物中活化分子百分数增大,有效碰撞几率增大,所以速率增大;
D.保持容器体积不变加入氦气,反应物的浓度不变,则反应速率不变;
故答案为:
.
| 1mol |
| 2L |
| 0.55mol |
| 2L |
| 0.45mol |
| 2L |
根据以上数据作图:
 ,
,故答案为:
 ;
;(2)由表中数据看出反应从开始到平衡,X的物质的量减小,应为反应物,0~9min物质的量变化值为1.00mol-0.55mol=0.45mol,
Y的物质的量减小,应为反应物,0~9min物质的量变化值为1.00mol-0.10mol=0.90mol,
Z的物质的量增多,应为是生成物,物质的量的变化值为0.90mol,
根据物质的量的变化与化学计量数呈正比,则n(X):n(Y):n(Z)=0.45mol:0.90mol:0.90mol=1:2:2,则反应方程为:X+2Y?2Z;
故答案为:X+2Y?2Z;
(3)0-3min时间内产物Z的平均反应速率为:
| 0.5mol |
| 2L×3min |
(4)到达平衡时剩余的X为0.55mol,则转化的X为1mol-0.55mol=0.45mol,所以X的转化率α=
| 0.45 |
| 1.00 |
故答案为:45%;
(5)A.降低温度,反应物中活化分子百分数减小,有效碰撞几率减小,所以反应速率减小;
B.将容器的体积改为1L,则容器的体积缩小,反应物的浓度增大,反应物中活化分子数目增大,有效碰撞几率增大,所以速率增大;
C.使用催化剂能降低反应所需活化能,反应物中活化分子百分数增大,有效碰撞几率增大,所以速率增大;
D.保持容器体积不变加入氦气,反应物的浓度不变,则反应速率不变;
故答案为:
| 改变的反应条件 | 反应速率改变的结果 |
| 降低反应体系的温度 | 减小 |
| 将容器的体积改为1L | 增大 |
| 使用催化剂 | 增大 |
| 保持容器体积不变,充入一定量氦气,增大压强 | 不变 |
点评:本题考查了反应速率的计算,影响反应速率的因素,化学平衡的有关问题等,是对反应原理应用的考查,题目难度较大.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A、澄清透明溶液:H+、Na+、SO42-、C6H5O- | ||
B、常温下
| ||
| C、铁片加入产生气泡的溶液:Na+、NH4+、I-、NO2- | ||
| D、NaHCO3溶液:K+、Na+、SO42-、Al3+ |
下列各组物质之间能发生置换反应的是( )
| A、CO通入灼热的三氧化二铁 |
| B、氯气通入碘化钠溶液中 |
| C、碘水加入溴化钠溶液中 |
| D、溴水加入氯化钠镕液中 |
下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是( )
| A、2NO2?N2O4 (正反应为放热反应) |
| B、3O2?2O3 (正反应为吸热反应) |
| C、H2(g)+I2(g)?2HI(g) (正反应为放热反应) |
| D、NH4HCO3(S)?NH3(g)+H2O(g)+CO2(g) (正反应为吸热反应) |
 单质X2、Y和化合物Z的组成元素均为周期表中前20号元素,表格和图分别是X2、Y 和Z的有关信息以及他们之间的转化关系 (其他无关物质已略去).请回答下列问题:
单质X2、Y和化合物Z的组成元素均为周期表中前20号元素,表格和图分别是X2、Y 和Z的有关信息以及他们之间的转化关系 (其他无关物质已略去).请回答下列问题: