题目内容
5.高铁酸钾(K2FeO4)是新型多功能水处理剂,碱性条件下性质稳定,其生产过程如图: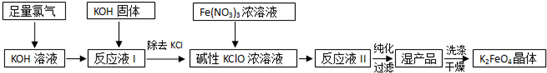
请回答下列问题:
(1)氯碱工业制Cl2的化学反应方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)生成“反应液Ⅱ”的离子方程式是3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
(3)使用碱性KClO的原因是KClO氧化性强于K2FeO4;
(4)从“反应液Ⅱ”中分离出K2FeO4后,副产品是KCl和KNO3(填化学式),该混合物可用D方法分离提纯(填字母序号);
A.过滤 B.分液 C.蒸馏 D.重结晶
(5)工业生产3.96t K2FeO4,理论上消耗Cl2的物质的量为3.00×104mol.
分析 足量Cl2通入和KOH溶液中,温度低时发生反应Cl2+2OH-=Cl-+ClO-+H2O,向溶液I中加入KOH,使氯气完全反应,且将溶液转化为碱性溶液,只有碱性条件下次氯酸根离子才能和铁离子发生氧化还原反应生成高铁酸根离子,除去KCl得到碱性的KClO浓溶液,向碱性的KClO浓溶液中加入浓Fe(NO3)3溶液,发生反应2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到溶液II,纯化得到湿产品,将湿产品洗涤、干燥得到晶体K2FeO4,以此解答该题.
解答 解:(1)工业用电解饱和食盐水制备氯气,方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$ 2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$ 2NaOH+H2↑+Cl2↑;
(2)Fe(NO3)3溶液与碱性KClO溶液反应生成高铁酸钾和氯化钾,反应的化学方程式为2Fe(NO3)3+3KClO+10KOH=2K2FeO4+3KCl+6KNO3+5H2O,
对应的离子反应方程式为3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O,
故答案为:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
(3)K2FeO4碱性条件下稳定,且KClO氧化性强于K2FeO4,可氧化铁离子生成K2FeO4,为了得到稳定的目标道白,应选择使用碱性KClO,
故答案为:KClO氧化性强于K2FeO4;
(4)由工艺流程及③可知,从“反应液II”中分离出K2FeO4后,会有副产品KNO3、KCl,根据二者的溶解度随温度变化情况,选择用重结晶的方法进行分离,
故答案为:KNO3; D;
(5)根据反应Cl2+2OH-=Cl-+ClO-+H2O和2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,可得关系式2K2FeO4~3Cl2,3.96tK2FeO4的物质的量为2×104mol,根据关系式可知氯气的物质的量为3.00×104mol,
故答案为:3.00×104.
点评 本题考查物质的分离和提纯,为高频考点,侧重考查学生分析、计算能力和思维的缜密性,涉及氧化还原反应方程式的配平、离子方程式的书写,会从整体上分析物质分离流程,知道每一步发生的反应及基本操作,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 金属氧化物 氧化铁 FeO | B. | 酸性氧化物 二氧化硫 SO2 | ||
| C. | 酸 硫酸 H2SO4 | D. | 碱 纯碱 Na2CO3 |
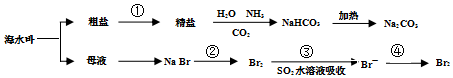
| A. | 工业上通过电解熔融状态MgCl2制取金属镁 | |
| B. | 用澄清石灰水可鉴别NaHCO3和Na2CO3 | |
| C. | 在第②、④步骤中,溴元素均被氧化 | |
| D. | 制取NaHCO3的反应中,利用了其溶解度在相同条件下小于NaCl的性质 |
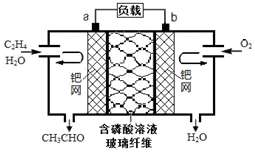 乙烯直接氧化法制乙醛的总反应方程式为2CH2═CH2+O2$\stackrel{PdCl_{2}•CuCl_{2}}{→}$2CH3CHO.下列有关说法正确的是( )
乙烯直接氧化法制乙醛的总反应方程式为2CH2═CH2+O2$\stackrel{PdCl_{2}•CuCl_{2}}{→}$2CH3CHO.下列有关说法正确的是( )| A. | 该电池可实现化学能与电能的相互转化 | |
| B. | 电子移动方向:电极a→磷酸溶液→电极b | |
| C. | 放电时,电路中每转移0.4mol电子,溶液中就有0.4molH+向负极迁移 | |
| D. | 该电池的负极反应式为:CH2═CH2-2e-+H2O=CH3CHO+2H+ |
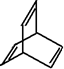 的有机物X的说法不正确的是( )
的有机物X的说法不正确的是( )| A. | X的化学式为C8H8 | |
| B. | 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为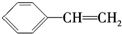 | |
| C. | X能使酸性高锰酸钾溶液褪色 | |
| D. | X与足量的H2在一定条件下反应可生成环状饱和烃Z,Z的一氯代物有4种 |
| A. | 短期保存Br2:盛于磨口的细口瓶中,并用水封,瓶盖严密 | |
| B. | 锂、钠、钾都保存在煤油中,密封 | |
| C. | 氨水、浓盐酸易挥发必须保存在棕色磨口细口瓶中 | |
| D. | 红磷无需密封保存 |
| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(X) | n(Y) | n(M) | n(N) | ||
| ① | 800 | 0.10 | 0.40 | 0.080 | 0.080 |
| ② | 800 | 0.20 | 0.80 | a | a |
| ③ | 900 | 0.10 | 0.15 | 0.06 | 0.06 |
| A. | 实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016mol/(L•min) | |
| B. | 实验②中,该反应的平衡常数K=12.5 | |
| C. | 实验②中,达到平衡时,a大于0.16 | |
| D. | 正反应为放热反应 |
 .
.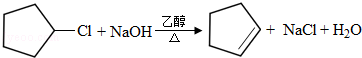 .
.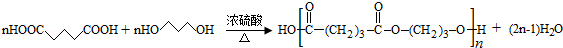 .
.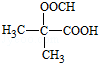 (写构简式)
(写构简式)