题目内容
13.下列说法正确的是( )| A. | 任何酸与碱发生中和反应生成1mol H2O的过程中,能量变化均相同 | |
| B. | 已知:C (s,石墨)=C (s,金刚石)△H=+1.5 kJ•mol-1,则金刚石比石墨更稳定 | |
| C. | 若①2H2 (g)+O2 (g)=2H2O (g)△H=-a kJ•mol-1,②2H2 (g)+O2 (g)=2H2O (l)△H=-b kJ•mol-1,则 b>a | |
| D. | 能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
分析 A.根据中和热的概念分析;
B.物质的能量越低越稳定;
C.△H=Q(生成物能量和)-Q(反应物能量和),水蒸气比液体水能量高.
D.化学反应能否自发决定于△H-T△S的大小.
解答 解:A.只有强酸和强碱的稀溶液中和生成1mol水时,放出的热量才是中和热,弱酸弱碱没有完全电离,电离时需吸收能量,放出的热量少,故A错误;
B.C(s,石墨)=C(s,金刚石)的△H>0,说明金刚石能量高,能量越低越稳定,石墨比金刚石稳定,故B错误;
C.△H=Q(生成物能量和)-Q(反应物能量和),水蒸气比液体水能量高,所以生成液态水放出的热量多,b>a,故C正确;
D.化学反应能否自发决定于△H-T△S的大小,△H和△S共同决定一个化学反应能否自发进行,故D错误.
故选C.
点评 本题考查了中和热、物质稳定性与能量的关系、反应自发性的判断,题目难度不大,侧重于基础知识的考查,注意把握中和热的概念以及反应自发性的判断方法.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
3.如图所示的装置可用于( )


| A. | 加热NaHCO3制CO2 | B. | 用Cu与稀硝酸反应制NO | ||
| C. | 用NH4Cl与浓NaOH溶液反应制NH3 | D. | 用锌与稀硫酸反应制H2 |
8.在CH3COOH溶液中存在如下平衡:CH3COOH?CH3COO-+H+.加入少量下列物质或采取下述方法,能使平衡逆向移动的是( )
| A. | 加水 | B. | CH3COONa固体 | C. | 升温 | D. | NaCl固体 |
18.用NA表示阿伏伽德罗常数的值,下列叙述中不正确的是( )
| A. | 28g乙烯和环丁烷的混合气体中含有的碳原子数为2NA | |
| B. | 常温常压下,46gNO2和N2O4的混合气体中含有的原子数为3NA | |
| C. | 标准状况下,22.4L水中含有的质子数为10NA | |
| D. | 1molNa与足量的O2反应,生成Na2O和Na2O2的混合物,转移电子数为NA |
2.下列有关化学反应的判断不正确的是( )
| A. | BaC03(s)=BaO(s)+CO2(g)在高温下能自发进行,推知△H>0 | |
| B. | 2CO(g)=2C(s)+O2(g)是吸热反应,推知该反应在低温下能自发进行 | |
| C. | 4NH3(g)+5O2(g)=4N0(g)+6H2O(g)是放热反应,推知该反应能自迸行 | |
| D. | N2(g)+3H2(g)=2NH3(g)是熵减的放热反应,推知该反应在低温下能自迸行,但在实际生产中,为了保证反应速率,常采用高温、高压、催化剂等条件 |
 (注:R、R′为径基).A为有机合成中间体,可发生银镜反应.A在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化.
(注:R、R′为径基).A为有机合成中间体,可发生银镜反应.A在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化.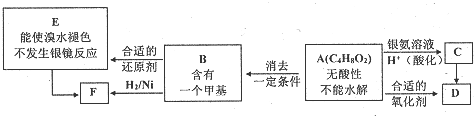
 或
或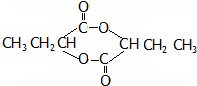 .
. .
.