题目内容
14.化学与社会、生产、生活密切相关.下列说法正确的是( )| A. | 用pH试纸测得新制氯水的pH为5 | |
| B. | 向某种消毒液(NaClO)中滴加盐酸,能抑制NaClO水解,降低漂白效果 | |
| C. | 铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用 | |
| D. | 为便于储存,需要将氯气液化[Cl2(g)?Cl2(l)],可以采取加压或者升温的措施 |
分析 A.氯水有漂白性,能够漂白试纸;
B.盐酸与次氯酸钠反应生成次氯酸,可以增强漂白性;
C.液氯与苯在铁做催化剂条件下反应生成氯苯;
D.依据平衡移动原理判断.
解答 解:A.由于氯水有漂白性,所以不能用pH试纸测新制氯水的pH,A错误;
B.盐酸与次氯酸钠反应生成次氯酸,可以增强漂白性,B错误;
C.氯化铁对氯与苯的反应有催化作用,C正确;
D.[Cl2(g)?Cl2(l)],反应物能量高于生成物能量,正向放热,应该降温或者加压储存液氯,故D错误;
故选:C.
点评 本题考查了氯气、次氯酸的性质,化学平衡移动的影响因素,题目难度不大,熟悉物质的性质及平衡移动理论即可解答.

练习册系列答案
相关题目
4.下列物质的转化在给定条件下不能实现的是( )
| A. | Ca(ClO)2(aq)$\stackrel{CO_{2}}{→}$HClO(aq)$\stackrel{光照}{→}$HCl(aq) | |
| B. | NaCl(饱和)$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | Al2O3$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| D. | NaAlO2(aq)$\stackrel{过量盐酸}{→}$AlCl3$\stackrel{电解}{→}$Al |
5.下列说法中正确的是( )
| A. | 氯化钠在电流的作用下电离出Na+和Cl- | |
| B. | CaCO3难溶于水,但CaCO3属于强电解质 | |
| C. | 二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质 | |
| D. | 硫酸钠在水中的电离方程式可表示为Na2SO4═2Na++S6++4O2- |
2.一定条件下,反应N2(g)+3H2(g)?2NH3(g)在10L的密闭容器中进行,测得2min内N2的物质的量由20mol减小到8mol,则2min内用NH3表示的反应速率为( )
| A. | 1.2mol/(L•min) | B. | 6.0mol/(L•min) | C. | 0.6mol/(L•min) | D. | 0.4mol/(L•min) |
19.材料在生产和日常生活中有着广泛的应用.下列叙述正确的是( )
| A. | 玻璃钢是复合材料 | B. | 铝是黑色金属材料 | ||
| C. | 石英是半导体材料 | D. | 水泥是新型无机非金属材料 |
6.不能用于比较Na与Al金属性相对强弱的事实是( )
| A. | Na和AlCl3溶液反应 | B. | 最高价氧化物对应水化物的碱性 | ||
| C. | 单质与H2O反应的难易程度 | D. | 同浓度NaCl和AlCl3溶液的pH |
3.25℃时,下列叙述正确的是( )
| A. | 将pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| B. | NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(Na+)=2c(SO42-) | |
| C. | 0.1 mol•L-1CH3COOH溶液与0.1 mol•L-1CH3COONa等体积混合后pH<7,则c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | KNO3和CH3COONH4溶液pH均为7,两溶液中水的电离程度相同 |
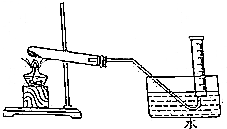 为验证MnO2在KClO3受热分解制O2的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:
为验证MnO2在KClO3受热分解制O2的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验: