题目内容
19.下列实验过程中,始终无明显现象的是( )| A. | CO2通入饱和Na2CO3溶液中 | B. | SO2通入CaCl2溶液中 | ||
| C. | NH3通入HNO3和AgNO3的混和溶液中 | D. | SO2通入Na2S溶液中 |
分析 A.碳酸钠与CO2和水反应生成酸式盐NaHCO3,NaHCO3溶解度小于Na2CO3,溶液中有浑浊出现;
B.盐酸酸性强于亚硫酸,CaCl2溶液中通入SO2不发生反应;
C.一开始是酸碱中和,没有沉淀产生,当硝酸完全中和后,氨水与银离子生成氢氧化银沉淀,逐渐增多,达到最大时,氢氧化银沉淀和氨水发生络合,生成可溶的银氨络离子,直至沉淀全部溶解;
D.Na2S为还原剂,SO2为氧化剂,生成硫沉淀.
解答 解:A.碳酸钠与CO2和水反应生成酸式盐NaHCO3,NaHCO3溶解度小于Na2CO3,并且反应生成的NaHCO3固体质量比原来Na2CO3多,溶剂质量减少,溶液中有浑浊出现,故A不选;
B.盐酸的酸性大于亚硫酸的酸性,则CaCl2溶液中通入SO2不发生反应,始终无明显现象,故B选;
C.NH3通入硝酸和硝酸银的混合溶液中,先与硝酸反应,故开始没有沉淀,等硝酸全部反应完全后,再与硝酸银反应生成氢氧化银沉淀,再继续通入氨气会生成可溶性的银氨溶液,故沉淀又会减少,直至最终没有沉淀,反应方程式为NH3+HNO3=NH4NO3、NH3+AgNO3+H2O=AgOH↓+NH4NO3、AgOH+2NH3=Ag(NH3)2OH(银氨溶液),故C不选;
D.SO2通入Na2S溶液中发生反应:2Na2S+5SO2+2H2O═4NaHSO3+3S↓,生成硫沉淀,故D不选;
故选B.
点评 本题考查元素化合物知识,掌握碳、硫、氮及其化合物的性质是解答关键,题目难度不大.

练习册系列答案
相关题目
12.某消毒液的主要成分为NaClO,下列有关该混合溶液的叙述正确的是( )
| A. | 该溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存 | |
| C. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 | |
| D. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O |
10.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 无色透明的溶液中:Na+、MnO4-、NO3-、Br- | |
| B. | 0.1 mol•L-1CaCl2溶液中:Mg2+、NH4+、CO32-、SO42- | |
| C. | Kw/c(OH-)=10-12 mol•L-1的溶液:Na+、K+、SiO32-、Cl- | |
| D. | 水电离产生的c(H+)=10-12 mol•L-1的溶液中:K+、Fe2+、NO3-、Cl- |
7.下列事实或实验可以表明H2SO3的酸性强于H2CO3的是( )
| A. | 硫的非金属性比碳强 | |
| B. | SO2气体依次通过NaHCO3溶液、澄清石灰水,澄清石灰水变浑浊 | |
| C. | SO2和CO2气体分别通入水中至饱和,测定两溶液的pH,前者小于后者 | |
| D. | 室温下测定均为0.1mol/L的NaHSO3和NaHCO3溶液的pH,前者小于后者 |
14.根据下列操作及现象,所得结论正确的是( )
| 序号 | 操作及现象 | 结论 |
| A | 向溴水中加入少量苯,振荡静置后水层为无色 | 苯与Br2发生了加成反应 |
| B | 向某无色溶液中滴加硝酸酸化的BaCl2溶液,产生白色沉淀 | 原溶液中一定含有SO42- |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 将1mL KSCN溶液与1mL 同浓度FeCl3溶液充分混合;再继续加入KSCN溶液,溶液颜色加深 | 证明溶液中存在平衡:Fe3++3SCN?Fe(SCN)3 |
| A. | A | B. | B | C. | C | D. | D |
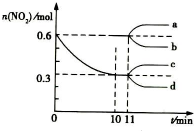 汽车尾气中CO、NO2在一定条件下可发生反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200KJ/mol,一定温度下,向容积固定为 2L的密闭容器中充入一定量的 CO和 NO2,NO2 的物质的量随时间的变化曲线如图所示
汽车尾气中CO、NO2在一定条件下可发生反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200KJ/mol,一定温度下,向容积固定为 2L的密闭容器中充入一定量的 CO和 NO2,NO2 的物质的量随时间的变化曲线如图所示 过氧化氢是实验室常用的试剂,在医疗、军事及工业上用途也非常广泛.回答下列问题:
过氧化氢是实验室常用的试剂,在医疗、军事及工业上用途也非常广泛.回答下列问题: