题目内容
5.设NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 1molFe与足量氯气充分反应时转移的电子数为2NA | |
| B. | 18 g水中所含的电子数为10NA | |
| C. | 0.3 mol•L-1Na2SO4溶液中含0.6NA个Na+ | |
| D. | 11.2 L氮气中含NA个氮原子 |
分析 A.氯气足量,反应生成氯化铁,1mol铁与足量氯气反应最多生成3mol电子;
B.水分子中含有10个电子,根据n=$\frac{m}{M}$计算出水的物质的量,再计算出含有电子的物质的量及数目;
C.缺少溶液体积,无法计算溶液中含有钠离子数目;
D.没有告诉在标况下,不能使用标况下的气体摩尔体积计算.
解答 解:A.1molFe与足量氯气充分反应最多失去3mol电子,转移的电子数为3NA,故A错误;
B.18g水的物质的量为1mol,1mol水分子中含有10mol电子,所含的电子数为10NA,故B正确;
C.没有告诉0.3 mol•L-1Na2SO4溶液的体积,无法计算硫酸钠的物质的量,故C错误;
D.不是标况下,不能使用标准状况下的气体摩尔体积计算,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,明确标况下气体摩尔体积的使用条件为解答关键,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
15.下列物质能与金属镁发生反应,并产生氢气的是( )
| A. | 氯化铵溶液 | B. | 氢氧化钠溶液 | C. | 热的苯 | D. | 热的无水乙醇 |
13.下列叙述正确的是( )
| A. | 铝元素是地壳中含量最多的元素 | |
| B. | 工业炼铝采用电解熔融的铝土矿的方法 | |
| C. | 冰晶石能使氧化铝熔融温度降低 | |
| D. | 工业上可用电解熔融氯化铝制取金属铝 |
17.下列反应离子方程式正确的是( )
| A. | 碳酸钙溶于稀盐酸中:CO32-+2H+═H2O+CO2↑ | |
| B. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| C. | 铁与稀盐酸反应:2Fe+6H+═3H2↑+2Fe3+ | |
| D. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
14.2015 年获得诺贝尔生理学或医学奖的是( )
| A. | 莫言 | B. | 韩寒 | C. | 屠呦呦 | D. | 鲍勃•迪伦 |
16.氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(1)△H=-571.6kJ.mol-1,下列判断不正确的是( )
| A. | 反应物能量总和大于生成物能量总和 | |
| B. | 反应中生成1mol水蒸气放出285.8 kJ的热量 | |
| C. | 2H2O(1)=2H2(g)+O2(g)△H=+571.6 kJ.mol-1 | |
| D. | 当反应中有2 mol H-H键断裂,该反应放出571.6 kJ的热量 |

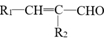 +H2O
+H2O +R2-OH$\stackrel{一定条件}{→}$
+R2-OH$\stackrel{一定条件}{→}$ .
. .
.