题目内容
3.相同温度相同物质的量浓度的六种溶液:①NaHCO3 ②CH3COONa ③NaOH ④Ba(OH)2 ⑤NaHSO4按pH值由大到小的顺序是( )| A. | ⑤②①④③ | B. | ⑤①②③④ | C. | ④③②①⑤ | D. | ④③①②⑤ |
分析 根据溶液的酸碱性以及利用盐类的水解程度比较浓度相同的溶液的pH大小,⑤NaHSO4为强酸的酸式盐,水溶液呈酸性;①NaHCO3、②CH3COONa都是强碱弱酸盐,水溶液呈碱性;-,③NaOH溶液,④Ba(OH)2是强碱,分别为一元碱和二元碱;
解答 解:同温度相同物质的量浓度下列溶液中,
⑤NaHSO4为强酸的酸式盐,水溶液呈酸性;
①NaHCO3、②CH3COONa都是强碱弱酸盐,水溶液呈碱性,对应酸的酸性越弱水解程度越大,溶液中氢氧根离子浓度越大,pH越大,①②对应酸根离子的水解程度大小为CH3COO-<HCO3-,③NaOH溶液,④Ba(OH)2是强碱,PH大小④>③,所以pH由大到小的顺序④③①②⑤,
故选D.
点评 本题考查了溶液PH的大小比较方法应用,主要是离子水解的应用,酸越弱,阴离子水解程度越大,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.实验室欲用Na2CO3•10H2O晶体配制1mol/L的Na2CO3溶液100mL,下列说法正确的是( )
| A. | 要完成实验需称取10.6gNa2CO3•10H2O晶体 | |
| B. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度线,会导致溶液浓度偏高 | |
| C. | 配制时若容量瓶不干燥,含有少量蒸馏水会导致浓度偏低 | |
| D. | 定容时俯视刻度线会导致浓度偏高 |
14.25℃时有关弱酸的电离平衡常数关系为:Ki(CH3COOH)>Ki1(H2CO3)>Ki(HCN)>Ki2(H2CO3).在冰醋酸中逐滴加水,溶液导电性和加水体积的关系如图所示.下列说法正确的是( )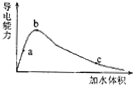

| A. | 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) | |
| B. | 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小 | |
| C. | 混合溶液中含有等物质的量的Na2CO3和NaHCO3,则一定存在c(Na+)+c(H+)═c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大于a |
11.下列反应的离子方程式正确的是( )
| A. | 石英与烧碱溶液共热:SiO2+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$SiO32-+H2O | |
| B. | 在氯化铝溶液中滴加过量的氨水:Al3++4OH-=[Al(OH)4]- | |
| C. | 在氢氧化钠溶液中通入过量的CO2:2OH-+CO2=CO32-+H2O | |
| D. | 稀硫酸与氢氧化钡溶液反应H++SO42-+Ba2++OH-=BaSO4↓+H2O |
18.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol醇和2mol乙酸,该醇的分子式为( )
| A. | C14H18O5 | B. | C14H22O3 | C. | C16H26O5 | D. | C16H20O3 |
8.与0H?具有相同质子数和电子数的粒子是( )
| A. | F? | B. | C1? | C. | NH3 | D. | H2O |
15.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,2.24 L F2所含原子数为0.1NA | |
| B. | 4.4gCO2中氧分子的个数为0.1NA | |
| C. | 78g Na2O2固体中Na+的个数目为NA | |
| D. | 2.3gNa完全燃烧后失去电子的个数为0.1NA |
 .
. .
.