题目内容
14.(1)下列实验操作或对实验事实的描述不正确的是D(填序号).A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1mol•L-1NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
①如图1所示的仪器中配制溶液肯定不需要的是AC(填序号);配制上述溶液还需用到的玻璃仪器是玻璃棒、烧杯(填仪器名称).
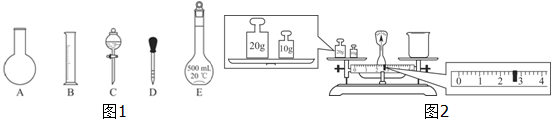
②下列操作中,容量瓶所不具备的功能有BCDE(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
③请计算需用托盘天平称取固体NaOH的质量为2.0g.某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图2.由图中可以看出,烧杯的实际质量为27.4g.
④根据计算得知,所需质量分数为98%、密度为1.84g•cm-3的浓硫酸的体积为13.6mL(计算结果保留一位小数).配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是浓硫酸稀释放出大量的热,将浓硫酸沿器壁(或玻璃棒)慢慢注入水中,且边加边搅拌.
分析 (1)A.瓷坩埚中二氧化硅与NaOH、碳酸钠等反应;
B.俯视刻度线定容后,水加少了,则溶液体积偏小;
C.分液时避免上下液体混合;
D.托盘天平的感量为0.1g;
E.硝酸钾和氯化钠的溶解度受温度影响不同;
(2)①根据配制一定物质的量浓度溶液步骤选择合适的仪器;
②容量瓶不能稀释浓溶液、不能用于溶解固体、储存溶液等;
③依据m=CVM计算需要的氢氧化钠的质量;依据托盘天平的使用方法读取烧杯的质量;
④根据c=$\frac{1000ρω}{M}$计算浓硫酸的浓度,再根据浓硫酸稀释前后溶质的物质的量不变计算;依据浓硫酸稀释的正确操作解答.
解答 解:(1)A.瓷坩埚中二氧化硅与NaOH、碳酸钠等反应,则不能用瓷坩埚灼烧氢氧化钠或碳酸钠,故A正确;
B.俯视刻度线定容后,水加少了,则溶液体积偏小,由c=$\frac{n}{V}$可知,浓度偏大,故B正确;
C.分液时避免上下液体混合,则分液时下层液体从下口流出,上层液体从上口倒出,故C正确;
D.托盘天平的感量为0.1g,则用托盘天平称量11.7g氯化钠晶体或用托盘天平称量11.8g氯化钠晶体,故D错误;
E.硝酸钾和氯化钠的溶解度受温度影响不同,可选结晶法分离,故E正确;
故选D.
(2)①配制一定物质的量浓度溶液的步骤有:计算、称量(量取)、溶解(稀释)、移液、洗涤、定容、摇匀、装瓶等,用的仪器有:托盘天平(量筒)、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管,不需要的仪器有烧杯和分液漏斗,要配置450ml溶液应选择500ml容量瓶,所有用不到的仪器:AC;还需要的仪器:玻璃棒和烧杯;
故答案为:AC;玻璃棒、烧杯;
②容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,
故答案为:BCDE;
③要配置450ml0.1mol•L-1NaOH溶液应选择500ml容量瓶,需要氢氧化钠的质量=0.1mol/L×0.5L×40g/mol=2.0g;
托盘天平使用应遵循左物右码的原则,物码放反,则砝码的质量等于物的质量+游码的质量,则质量=砝码的质量-游码的质量,所以实际质量=30g-2.6g=27.4g,
故答案为:2.0;27.4;
④质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度为=$\frac{1000×1.84×98%}{98}$=18.4mol/L,配0.5mol•L-1硫酸溶液500mL,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.5/L×0.5L,得V=0.0136L=13.6mL,浓硫酸稀释放出大量的热,将浓硫酸沿器壁(或玻璃棒)慢慢注入水中,且边加边搅拌;
故答案为:13.6;浓硫酸稀释放出大量的热,将浓硫酸沿器壁(或玻璃棒)慢慢注入水中,且边加边搅拌.
点评 本题考查了一定物质的量浓度溶液的配制,熟悉配制过程是解题关键,注意托盘天平、容量瓶的使用方法,题目难度不大.

| A. | Fe+2HCl═FeCl2+H2↑ | |
| B. | 2HCl+Ca(ClO)2═2HClO+CaCl2 | |
| C. | I2+2NaClO3═2NaIO3+Cl2↑ | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题: