题目内容
下列离子方程式书写正确的是( )
| A、Fe3O4溶于稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B、铝片溶于NaOH溶液:Al+2OH-=AlO2-+H2↑ |
| C、向苯酚钠溶液中通入少量CO2;C6H5O-+CO2+H2O→C6H5OH+HCO3- |
| D、向含1mol碘化亚铁的溶液中通入标准状况下22.4L氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.发生氧化还原反应,生成硝酸铁、NO和水;
B.水参加反应;
C.反应生成苯酚和碳酸氢钠;
D.标准状况下22.4L氯气,其物质的量为1mol,等物质的量反应时,只有碘离子被氧化.
B.水参加反应;
C.反应生成苯酚和碳酸氢钠;
D.标准状况下22.4L氯气,其物质的量为1mol,等物质的量反应时,只有碘离子被氧化.
解答:
解:A.Fe3O4溶于稀HNO3的离子反应为NO3-+3Fe3O4+28H+=9Fe3++14H2O+NO↑,故A错误;
B.铝片溶于NaOH溶液的离子反应为2Al+2H2O+2OH-=2AlO2-+3H2↑,故B错误;
C.向苯酚钠溶液中通入少量CO2的离子反应为C6H5O-+CO2+H2O→C6H5OH+HCO3-,故C正确;
D.向含1mol碘化亚铁的溶液中通入标准状况下22.4L氯气的离子反应为2I-+Cl2=I2+2Cl-,故D错误;
故选C.
B.铝片溶于NaOH溶液的离子反应为2Al+2H2O+2OH-=2AlO2-+3H2↑,故B错误;
C.向苯酚钠溶液中通入少量CO2的离子反应为C6H5O-+CO2+H2O→C6H5OH+HCO3-,故C正确;
D.向含1mol碘化亚铁的溶液中通入标准状况下22.4L氯气的离子反应为2I-+Cl2=I2+2Cl-,故D错误;
故选C.
点评:本题考查离子反应方程式的书写,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及与量有关的离子反应书写,综合性较强,较好的训练学生思维的严密性,有利于分析能力的培养,选项D为解答的难点,题目难度不大.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
在自然界中既能以游离态存在又能以化合态存在的元素是( )
| A、钠 | B、硫 | C、氯 | D、钙 |
建筑装潢质量的问题之一是装潢装饰材料中某些化学成分含量太高,缓慢释放出来,在空气中浓度过高,影响人体健康.这某些化学成分主要是( )
| A、甲烷 | B、乙烯 |
| C、乙炔 | D、甲醛、甲苯等有机物蒸气 |
下列操作达不到预期目的是( )
①将某卤代烃与氢氧化钠的水溶液共热,向冷却后的反应液中滴加AgNO3溶液,若产生白色沉淀,则证明该卤代烃为氯代烃
②用乙醇和30%的硫酸共热到170℃制取乙烯
③在少量苯酚稀溶液中滴入过量饱和溴水出现白色沉淀
④将苯与浓硝酸混合加热至60℃制备硝基苯
⑤检验淀粉已经水解,将淀粉与少量稀硫酸加热一段时间后,再加入银氨溶液加热.
①将某卤代烃与氢氧化钠的水溶液共热,向冷却后的反应液中滴加AgNO3溶液,若产生白色沉淀,则证明该卤代烃为氯代烃
②用乙醇和30%的硫酸共热到170℃制取乙烯
③在少量苯酚稀溶液中滴入过量饱和溴水出现白色沉淀
④将苯与浓硝酸混合加热至60℃制备硝基苯
⑤检验淀粉已经水解,将淀粉与少量稀硫酸加热一段时间后,再加入银氨溶液加热.
| A、①③④ | B、②③⑤ |
| C、①②④⑤ | D、①②③④⑤ |
与下列装置相关的说法中不正确的是( )

| A、图a中,接通开关时,插入海水中的铁棒,腐蚀速率加快 |
| B、图b中,开关由N改置于M时,Cu-Zn合金的腐蚀速率加快 |
| C、图c中装置用作精炼铜时,x极为粗铜 |
| D、图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
下列各装置中铜电极上能产生气泡的是( )
A、 |
B、 |
C、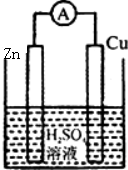 |
D、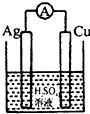 |
常温下,0.1mol/L NH3?H2O溶液中存在如下电离平衡:NH3?H2O?NH4++OH-下列叙述正确的是( )
| A、加入少量NaOH固体,平衡正向移动 |
| B、加入少量水稀释,溶液中c(H+)减小 |
| C、加入少量MgSO4固体,溶液pH减小 |
| D、加入少量NH4Cl固体,平衡正向移动,Kb不变 |