题目内容
4.在25℃的条件下,下列各组离子一定能在指定环境中大量共存的是( )| A. | pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42- | |
| B. | 水电离出的c(H+)=1×10-13mol/L的溶液中:K+、HCO3-、Cl-、S2- | |
| C. | 甲基橙呈红色的溶液中:Fe3+、Na+、SO42-、CO32- | |
| D. | 在AlCl3溶液中:Na+、AlO2-、NO3-、SO42- |
分析 A.pH=0的溶液,显酸性;
B.水电离出的c(H+)=1×10-13mol/L的溶液,为酸或碱溶液;
C.甲基橙呈红色的溶液,显酸性;
D.离子之间相互促进水解.
解答 解:A.pH=0的溶液,显酸性,该组离子之间不反应,可大量共存,故A正确;
B.水电离出的c(H+)=1×10-13mol/L的溶液,为酸或碱溶液,酸溶液中不能大量存在HCO3-、S2-,碱溶液中不能大量存在HCO3-,故B错误;
C.甲基橙呈红色的溶液,显酸性,不能大量存在CO32-,且Fe3+、CO32-相互促进水解不能大量共存,故C错误;
D.AlO2-、Al3+相互促进水解,不能大量共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、水解反应的判断,题目难度不大.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
14.用石墨电极电解下列溶液,阴极和阳极产生气体的体积比为2:1,其电解液pH不变的是( )
| A. | NaCl | B. | H2SO4 | C. | NaOH | D. | K2SO4 |
15.以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2,通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )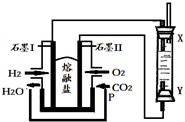

| A. | X、Y两端都必须用铁作电极 | B. | 不可以用NaOH溶液作为电解液 | ||
| C. | 阴极发生的反应是:2H++2e-=H2↑ | D. | 白色沉淀只能在阳极上产生 |
12.钢铁发生吸氧腐蚀时,负极上发生的电极反应是( )
| A. | 2H++2e-═H2↑ | B. | Fe-2e-═Fe2+ | ||
| C. | 4OH--4e-═2H2O+O2↑ | D. | Fe-3e-═Fe3+ |
9.下列有机反应中,属于加成反应的是( )
| A. | C6H12O6$\stackrel{酒化酶}{→}$2C2H6O+2CO2↑ | B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | ||
| C. | HC≡CH+HCl$\stackrel{一定条件}{→}$CH2=CHCl | D. | 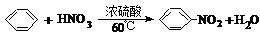 |
13.下列说法中不正确的是( )
| A. | 人类历史上使用最早的合金是青铜 | |
| B. | 金属钛有可能在21世纪得到广泛运用 | |
| C. | 广泛运用铝合金,是因为铝不能与酸、碱、O2等反应 | |
| D. | 目前世界上用途最广的合金是钢 |
14.下列物质中,属于天然高分子化合物的是( )
| A. | 油脂 | B. | 葡萄糖 | C. | 蛋白质 | D. | 聚氯乙烯 |