题目内容
7.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | CO2和CO分子组成的混合气共1mol,其中所含的分子数目为NA | |
| B. | 8.0gCuO与足量的H2充分反应生成的水在标准状况下体积为2.24L | |
| C. | 同温同压下,体积均为11.2L的CO2和SO2所含有氧原子数为NA | |
| D. | 1mol的钠离子含有NA个电子 |
分析 A、分子个数N=nNA;
B、水在标况下为液体;
C、气体所处的状态不一定是标况;
D、钠离子中含10个电子.
解答 解:A、1mol二氧化碳和CO混合气体中的分子个数N=nNA=1mol×NA/mol=NA个,故A正确;
B、水在标况下为液体,故不能根据气体摩尔体积来计算生成的水的体积,故B错误;
C、气体所处的状态不一定是标况,故11.2L混合气体的物质的量不一定是0.5mol,故含有的原子个数不一定是NA个,故C错误;
D、钠离子中含10个电子,故1mol钠离子的核外有10NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.金合欢醇广泛应用于多种香型的香精中,其结构简式如图所示.下列说法正确的是( )
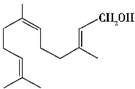

| A. | 金合欢醇与乙醇是同系物 | |
| B. | 金合欢醇可发生加成反应,但不能发生取代反应 | |
| C. | 1 mol 金合欢醇能与3 mol H2 反应,也能与3 mol Br2反应 | |
| D. | 1 mol 金合欢醇与足量Na 反应生成1mol 氢气,完全燃烧时消耗O2 21 mol |
18.化学反应可视为旧键断裂和新键形成的过程.共价键的键能是两种原子间形成1mol共价键(或其可逆过程)时释放(或吸收)的能量.已知H-H 键的键能为436kJ•mol-1,Cl-Cl键的键能为243kJ•mol-1,H-Cl键的键能为431kJ•mol-1,则H2 (g )+Cl2(g )═2HCl(g ) 的反应热(△H )等于( )
| A. | -183 kJ•mol-1 | B. | +183 kJ•mol-1 | C. | -862 kJ•mol-1 | D. | +862 kJ•mol-1 |
15.离子方程式2Ca2++3HCO3-+3OH-→2CaCO3↓+CO32-+3H2O可以表示( )
| A. | Ca(HCO3)2与NaOH溶液反应 | B. | Ca(HCO3)2与Ba(OH)2溶液反应 | ||
| C. | Ca(HCO3)2与与澄清石灰水反应 | D. | NH4HCO3与澄清石灰水反应 |
2.在Al2(SO4)3、K2SO4和明矾的混合溶液中,如果c(SO42-)等于0.2mol/L,c(Al3+)等于0.1mol/L,则原混合溶液中K+的物质的量浓度为( )
| A. | 0.2 mol/L | B. | 0.25 mol/L | C. | 0.1 mol/L | D. | 0.225 mol/L |
12.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )
| A. | 滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I- | |
| B. | pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+ |
16.下列溶液中氯离子的物质的量与50mLlmol/L AlC13溶液中n(Cl-)相等的是( )
| A. | 150mLlmol/L氯化钾 | B. | 150mL3mol/L氯化钾 | ||
| C. | 75mL2mol/L氯化钙 | D. | 150mL1mol/L氯化铁 |
17.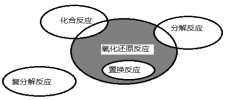 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )| A. | CuSO4+Mg=Cu+MgSO4 | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | 2Na2O2+2CO2═2Na2CO3+O2 | D. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
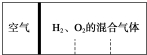 计算后填空:
计算后填空: