题目内容
3.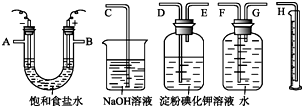 请用如图所示仪器设计一个电解饱和食盐水并测定电解时产生的H2的体积和检验Cl2的实验装置.(提示:Cl2可与KI反应生成I2,淀粉遇I2变蓝)
请用如图所示仪器设计一个电解饱和食盐水并测定电解时产生的H2的体积和检验Cl2的实验装置.(提示:Cl2可与KI反应生成I2,淀粉遇I2变蓝)(1)所选仪器连接时,各接口的顺序是(填各接口的字母代号):A接G、F接H;B接D、E接C.
(2)证明产物Cl2的实验现象是淀粉碘化钾溶液变蓝.
(3)实验测得产生的氢气体积(已折算成标准状况)为5.60mL,电解后溶液的体积恰好为50.0mL,则溶液中NaOH的物质的量浓度0.01mol•L-1.
分析 (1)用惰性电极电解饱和食盐水时,在阳极上产生氯气,在阴极上产生氢气和氢氧化钠,即A端为氢气,B端为氯气,A接储气瓶的G→F,把水排入量筒内,用量筒测量出排出的水量,以测定产生H2的体积,用淀粉KI溶液检验氯气,用NaOH溶液吸收氯气,防止污染环境;
(2)Cl2可与KI反应生成I2,淀粉遇I2变蓝色;
(3)根据n=$\frac{V}{{V}_{m}}$计算氢气物质的量,根据2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑计算NaOH物质的量,进而计算NaOH的物质的量浓度.
解答 解:(1)用惰性电极电解饱和食盐水时,在阳极上产生氯气,在阴极上产生氢气和氢氧化钠,即A端为氢气,B端为氯气,A接储气瓶的G→F,把水排入量筒内,用量筒测量出排出的水量,以测定产生H2的体积,B接洗气瓶的D→E,生成的Cl2在洗气瓶中使淀粉碘化钾溶液变蓝,多余的Cl2用NaOH溶液吸收,
故答案为:G;F;H;D;E;C;
(2)Cl2可与KI反应生成I2,淀粉遇I2变蓝色,
故答案为:淀粉碘化钾溶液变蓝;
(3)氢气物质的量为$\frac{0.0056L}{22.4L/mol}$=0.00025mol,由2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,可知n(NaOH)=2n(H2)=0.0005mol,则c(NaOH)=$\frac{0.0005mol}{0.05L}$=0.01mol•L-1,
故答案为:0.01mol•L-1.
点评 本题考查电解原理、化学实验、化学计算等,难度不大,关键是明确实验原理.

练习册系列答案
相关题目
13.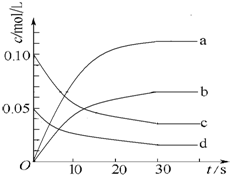 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如下表:
(1)计算该反应在20秒内用O2表示的反应速率v(O2)=0.0015mol•L-1•s-1.
(2)图中表示NO2的变化的曲线是b(填字母).
(3)能说明该反应已达到平衡状态的是b(填字母).
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是c(填字母).
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如下表:| 时间/s | 0 | 10 | 20 | 30 | 40 | 50 |
| n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(2)图中表示NO2的变化的曲线是b(填字母).
(3)能说明该反应已达到平衡状态的是b(填字母).
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是c(填字母).
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.
11.下列说法正确的是( )
| A. | 对于△S>0的反应,若在任何温度下均能自发进行,则该反应△H>0 | |
| B. | 氢氧燃料电池发电,比氢气直接在空气中燃烧发电能量转换率高 | |
| C. | 合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0,加入催化剂能加快反应速率并提高转化率 | |
| D. | Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+═SO42-+3S↓+H2O |
18.下列状态的物质,既能导电又属于电解质的是( )
| A. | MgCl2晶体 | B. | 熔融的KOH | C. | 液态HCl | D. | NaCl溶液 |
8.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2 L CCl4含有的分子数目为0.5NA | |
| B. | 1 mol Na2O2固体中含离子总数为3NA | |
| C. | 将10mL 1mol•L-1FeCl3溶液滴入沸水中,所得氢氧化铁胶粒数为0.01NA | |
| D. | 0.1 molH2O和D2O组成的混合物中含有中子数是NA |
12.下列有关实验的说法正确的是( )
| A. | 用干燥的pH试纸测定新制氯水的pH | |
| B. | 中和滴定实验中,洗净后的锥形瓶不需要干燥 | |
| C. | 用Na2S溶液与AlCl3溶液混合制取Al2S3 | |
| D. | 向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS) |
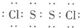 ,其晶体类型为分子晶体.
,其晶体类型为分子晶体.