题目内容
下列推断正确的是( )
| A、由H+(aq)+OH-(aq)=H20(1)△H=-57.3 kJ?mol-1,可知含1 mo1 CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ |
| B、由C(石墨)=C(金刚石)△H=+1.9 kJ?mol-1,可知石墨比金刚石更稳定 |
| C、由N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ?mol-1,可知将1 mol N2(g)和3 mol H2(g)置于密闭容器中充分反应后放出热量为92.4 kJ |
| D、由△G=△H-T△S可知,所有的放热反应都能自发进行 |
考点:有关反应热的计算,反应热和焓变
专题:
分析:A.乙酸是弱酸,电离过程是吸热过程;
B.物质具有的能量越低越稳定;
C.合成氨的反应为可逆反应;
D.反应自发进行由焓变、熵变、温度共同决定.
B.物质具有的能量越低越稳定;
C.合成氨的反应为可逆反应;
D.反应自发进行由焓变、熵变、温度共同决定.
解答:
解:A.乙酸是弱酸,电离过程是吸热过程,含1mol CH3COOH的溶液与含1mol NaOH的稀溶液混合,放出热量小于57.3 kJ,故A错误;
B.从C(石墨)═C(金刚石)△H=+1.9kJ/mol,可知石墨具有的能量较低,物质具有的能量越低越稳定,所以石墨比金刚石更稳定,故B正确;
C.已知N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ?mol-1,将1 mol N2(g)和3 mol H2(g)置于密闭容器中充分反应,该反应为可逆反应,氮气和氢气不能全部转化为氨气,则实际反应的氮气的物质的量小于1mol,则放出的热量小于92.4 kJ,故C错误;
D、反应自发进行由△G=△H-T△S<0确定,可知,放热反应△H<0,若高温下,△S<0,可能存在△G=△H-T△S>0,所以不是所有放热反应都能自发进行,故D错误;
故选B.
B.从C(石墨)═C(金刚石)△H=+1.9kJ/mol,可知石墨具有的能量较低,物质具有的能量越低越稳定,所以石墨比金刚石更稳定,故B正确;
C.已知N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ?mol-1,将1 mol N2(g)和3 mol H2(g)置于密闭容器中充分反应,该反应为可逆反应,氮气和氢气不能全部转化为氨气,则实际反应的氮气的物质的量小于1mol,则放出的热量小于92.4 kJ,故C错误;
D、反应自发进行由△G=△H-T△S<0确定,可知,放热反应△H<0,若高温下,△S<0,可能存在△G=△H-T△S>0,所以不是所有放热反应都能自发进行,故D错误;
故选B.
点评:本题考查了反应能量变化分析判断,中和热判断,反应自发进行的依据,可逆反应的应用,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列物质中,既能和盐酸反应,又能和氢氧化钠反应的物质是( )
| A、碳酸钠 | B、碳酸氢钠 |
| C、氯化钠 | D、硫酸铜 |
对于锌一铜一稀酸组成的原电池装置中,下列说法不正确的是( )
| A、锌是负极 |
| B、正极析出氢气 |
| C、锌片质量减小 |
| D、溶液变蓝色 |
形成下列分子时,一个原子用sp3杂化轨道和另一个原子的p轨道成键的是( )
| A、BF3 |
| B、CCl4 |
| C、NH3 |
| D、H2O |
与100mL 0.2mol/L CaCl2溶液中Cl-浓度相同的是( )
| A、50mL 0.1mol/L FeCl3溶液 |
| B、200mL 0.4mol/L NaCl溶液 |
| C、200mL 0.1mol/L MgCl2溶液 |
| D、200mL 0.2mol/L KCl溶液 |
根据表中信息判断,下列选项正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-… | Cl2、Mn2+… |
| A、第①组反应的其余产物只有O2 |
| B、第②组反应中Cl2与FeBr2的物质的量之比为1:2 |
| C、第③组反应中生成1molCl2,转移电子10mol |
| D、氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
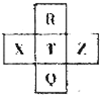 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中X单质与Na单质的固体研磨发生爆炸.则下列判断不正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中X单质与Na单质的固体研磨发生爆炸.则下列判断不正确的是( )| A、原子半径:R<T<X,非金属性:Z<X<T |
| B、R与Q原子的电子数相差26,属于VIIA族即卤族元素 |
| C、简单阴离子的半径:X>T,气态氢化物稳定性:R<T<Q |
| D、最高价氧化物对应水化物的酸性:T>X、T>Q |
