题目内容
下列物质中属于电解质的是( )
①氯化钠 ②NH3?H2O ③硫酸溶液 ④蔗糖 ⑤二氧化碳.
①氯化钠 ②NH3?H2O ③硫酸溶液 ④蔗糖 ⑤二氧化碳.
| A、①② | B、①④⑤ |
| C、①②③ | D、①⑤ |
考点:电解质与非电解质
专题:电离平衡与溶液的pH专题
分析:电解质的定义:电解质是指在水溶液中或在熔融状态下就能够导电的化合物,据此解答.
解答:
解:①氯化钠在水溶液中或在熔融状态下就能够导电,属于电解质;
②NH3?H2O 在水溶液中能够导电,属于电解质;
③硫酸溶液是混合物,既不是电解质也不是非电解质;
④蔗糖在水溶液中和在熔融状态下都不能够导电,属于非电解质;
⑤二氧化碳在水溶液中能够导电,但实际是二氧化碳和水反应生成的碳酸电离产生自由移动的离子而导电,而不是二氧化碳本身,在熔融状态下不能够导电,属于非电解质;
故选:A.
②NH3?H2O 在水溶液中能够导电,属于电解质;
③硫酸溶液是混合物,既不是电解质也不是非电解质;
④蔗糖在水溶液中和在熔融状态下都不能够导电,属于非电解质;
⑤二氧化碳在水溶液中能够导电,但实际是二氧化碳和水反应生成的碳酸电离产生自由移动的离子而导电,而不是二氧化碳本身,在熔融状态下不能够导电,属于非电解质;
故选:A.
点评:本题考查了电解质的判断,握电解质的定义是解题关键,注意电解质属于化合物,单质、混合物既不是电解质,已不是非电解质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
如图是两幅微观示意图,揭示了化学变化的微观实质.下列说法中正确的是( )
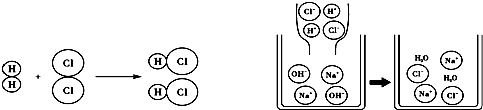

| A、该图可说明所有物质都是由分子构成的 |
| B、以上图示中未涉及置换反应 |
| C、两幅图表示的都是化合反应 |
| D、原子在化学变化中是可以再分的 |
设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、1mol甲醇中含有C-H键的数目为4NA |
| B、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| C、常温下,18g重水(D2O)所含的电子数为10NA |
| D、一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA |
下列颜色变化不是因化学反应引起的是( )
| A、湿润的淀粉碘化钾试纸遇氯气变蓝 |
| B、鸡皮遇稀硝酸呈黄色 |
| C、蔗糖遇浓硫酸变黑 |
| D、钠燃烧时火焰呈黄色 |
氢化铝钠(NaAlH4)是最有研究应用前景的络合金属氢化物,氢化铝钠储放氢时发生反应:3NaAlH4
Na3AlH6+2Al+3H2↑.下列说法正确的是( )
| ||
| A、NaAlH4中氢元素为+1价 |
| B、每生成11.2 L(标准状况下)H2,转移2NA个电子 |
| C、在反应中有50%的氢被氧化 |
| D、反应中氧化产物与还原产物的物质的量之比为1:1 |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、常温常压下,1.06gNa2CO3含有的Na+离子数为0.02 NA |
| B、标准状况下,0.5 mol/LBaCl2溶液中含有Cl-离子数为NA |
| C、通常状况下,NA个CO2分子占有的体积为22.4L |
| D、2.7g铝与盐酸完全反应失去0.2NA个电子 |
下列说法正确的是( )
| A、由于氧化性HNO3大于H2SO4,所以非金属性:氮大于硫 |
| B、科学家在金属和非金属交界线处寻找催化剂 |
| C、只有主族元素是由短周期和长周期元素共同构成的 |
| D、长周期主族元素X的阳离子X2+的最外层有2个电子,则它是IVA族元素 |
下列关于有机物的叙述不正确的是( )
| A、油脂在空气中完全燃烧生成二氧化碳和水 |
| B、蛋白质溶液中加入浓的硫酸铵溶液会发生盐析 |
| C、乙酸乙酯中混有的乙酸杂质可以用饱和碳酸钠溶液除去 |
| D、由CH2=CH-COOCH3合成的聚合物为[CH2-CH-COOCH3]n |