题目内容
1.已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子.又知B、C和D是由两种元素的原子组成.请回答(1)组成A分子的原子的核外电子排布式是1s22s22p63s23p6;
(2)B和C的分子式分别是HCl和H2S;C分子的立体结构呈V形,该分子属于极性分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成.则D的电子式是H2O2,该反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是CH4O.
分析 在18电子分子中,单原子分子A为Ar,B、C和D是由两种元素的原子组成,双原子分子B为HCl,三原子分子C为H2S,四原子分子D为PH3或H2O2,若向D的稀溶液中加入少量二氧化锰,有无色气体生成,符合题意的D为H2O2;根据燃烧规律可知E为CH4Ox,故6+4+8x=18,所以x=1,E的分子式为CH4O,据此解答
解答 解:在18电子分子中,单原子分子A为Ar,B、C和D是由两种元素的原子组成,双原子分子B为HCl,三原子分子C为H2S,四原子分子D为PH3或H2O2,且若向D的稀溶液中加入少量二氧化锰,有无色气体生成,符合题意的D为H2O2,根据燃烧规律可知E为CH4Ox,故6+4+8x=18,所以x=1,E的分子式为CH4O,
(1)Ar原子核外电子数为18,原子核外电子排布式为1s22s22p63s23p6,
故答案为:1s22s22p63s23p6;
(2)双原子分子B为HCl,三原子分子C为H2S,H2S中S原子价层电子对数=2+$\frac{1}{2}$(6-1×2)=4,因此S采取sp3杂化,S原子有2对孤对电子,故H2S为V型,分子中正负电荷重心不重合,属于极性分子,
故答案为:HCl;H2S;V;极性;
(3)四原子分子D为PH3或H2O2,若向D的稀溶液中加入少量二氧化锰,有无色气体生成,符合题意的D为H2O2,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案为:H2O2;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(4)1mol E在氧气中完全燃烧,只生成1mol CO2和2mol H2O,根据燃烧规律可知E为CH4Ox,故6+4+8x=18,所以x=1,E的分子式为:CH4O,
故答案为:CH4O.
点评 本题考查物质结构及性质,题目难度中等,正确推断物质是解本题关键,杂化方式的判断、核外电子排布式的书写、分子构型的判断等是高考热点,应重点掌握.

| A. | 甲烷和苯都能发生取代反应 | |
| B. | 氯乙烯、聚乙烯、苯乙烯都是不饱和烃,它们都能与溴的四氯化碳溶液发生加成反应 | |
| C. | 苯酚钠溶液中通入少量的二氧化碳,产物是苯酚和碳酸氢钠 | |
| D. | 苯不与任何酸反应,但能与溴在一定条件下发生反应 |
| A. | rF:rCl | B. | rI-:rI | C. | rMg2+:rNa+ | D. | rNa+:rNa |
| A. | SO32-→SO2 | B. | S2-→S | C. | AlO2-→Al3+ | D. | CO2→CO |
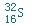 它的最高价氧化物对应的水化物的化学式:H2SO4.
它的最高价氧化物对应的水化物的化学式:H2SO4. .
.