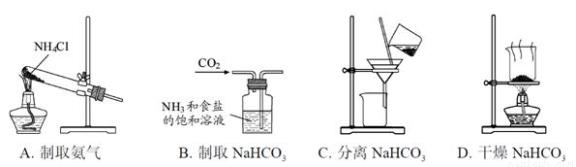
题目内容
1.碳酸钙和硫酸钙都是钙的重要化合物,它们在生产生活中都有着广泛的应用.甲、乙两组同学分别对碳酸钙的制备、硫酸钙的性质进行了以下探究,请你参与并完成对有关问题的解答.(1)甲组使用大理石(含少量的Fe2O3杂质)等物质制备碳酸钙的实验流程如下:

①溶解大理石时,用硝酸而不用硫酸的原因是硫酸钙微溶于水.
②上述流程中,“分离”得产品所包含的实验操作依次为:过滤、洗涤、干燥.
③“滤液A”中除H+离子外,还含有的阳离子是NH4+.
(2)乙组对某硫酸钙晶体(xCaSO4•yH2O)加热分解的有关反应进行探究.称取6.52g该晶体进行加热,加热过程中,固体质量随时间的变化情况如图所示.又知t5~t6时间段内固体质量减轻的原因是发生了2CaSO42CaO+2SO2↑+O2↑.

①加热时,该晶体开始发生化学变化的时间是t1(填“t1”、“t3”或“t5”).
②t4~t5时间段固体的化学式为CaSO4.
③tl~t2时间段固体发生反应的化学方程式为2CaSO4•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4•H2O+2H2O.
分析 大理石(含少量的Fe2O3杂质),加入硝酸溶解后的溶液中加入氨水沉淀铁离子生成氢氧化铁,过滤得到硝酸钙溶液,加入碳酸铵发生沉淀反应生成碳酸钙,分离得到碳酸钙固体和滤液A,滤液A”中除H+离子外,还含有的阳离子是铵根离子,
(1)①依据硫酸和碳酸钙反应生成的硫酸钙是微溶于水的物质,附着在大理石表面阻止反应进行;
②沉淀过滤后洗涤,干燥;
③依据流程分析,大理石与硝酸反应后生成硝酸钙,硝酸铁,加入一水合氨反应生成氢氧化铁沉淀,滤液中加入碳酸铵反应生成碳酸钙沉淀,过滤得到碳酸钙,滤液中含有氢离子,铵根离子;
(2)在加热到t1时xCaSO4•yH2O开始分解,t1~t2时间段和t3~t4时间段个固体的质量变化比较少,而t5~t6时间段固体质量变化较大,原因是t1~t2时间段生石膏脱去部分水,t3~t4时间段完全脱水,在t4时完全生成CaSO4,在t5~t6时间段温度较高,CaSO4开始分解,质量变化较大.
解答 解:(1)①硫酸和碳酸钙反应生成的硫酸钙是微溶于水的物质,附着在大理石表面阻止反应进行,所以选择硝酸反应;
故答案为:硫酸钙微溶于水;
②上述流程中,“分离”得产品为碳酸钙沉淀和硝酸铵溶液,所包含的实验操作依次为过滤,洗涤,干燥;
故答案为:过滤,干燥;
③大理石与硝酸反应后生成硝酸钙,硝酸铁,加入一水合氨反应生成氢氧化铁沉淀,滤液中加入碳酸铵反应生成碳酸钙沉淀,过滤得到碳酸钙,滤液中含有阳离子为氢离子,铵根离子,
故答案为:NH4+;
(2)①依据图象分析,固体质量在0-t1时间段无变化,说明固体未反应,加热到t1时,固体质量开始减小,所以该晶体开始发生化学变化的时间是t1;
故答案为:t1;
②在加热到t1时xCaSO4•yH2O开始分解,t1~t2时间段和t3~t4时间段个固体的质量变化比较少,而t5~t6时间段固体质量变化较大,原因是t1~t2时间段生石膏脱去部分水,t3~t4时间段完全脱水,t4~t5时间段固体的化学式为CaSO4;
故答案为:CaSO4;
③t3~t4时间段完全脱水,则m(H2O)=6.52g-5.44g=1.08g,m(CaSO4)=5.44g,n(H2O)=$\frac{1.08g}{18g/mol}$=0.06mol,n(CaSO4)=$\frac{5.44g}{136g/mol}$=0.04mol,所以n(CaSO4):n(H2O)=x:y=0.04:0.06=2:3,化学式为:2CaSO4•3H2O,tl~t2时间段固体质量变化,减少水的质量=6.52g-5.80g=0.72g,n(H2O)=$\frac{0.72g}{18g/mol}$=0.04mol;固体质量为5.80g,6.52g硫酸钙固体物质的量=$\frac{6.52g}{326g/mol}$=0.02mol,则1mol2CaSO4•3H2O失水2mol,反应的化学方程式为:2CaSO4•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4•H2O+2H2O,
故答案为:2CaSO4•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4•H2O+2H2O.
点评 本题考查了碳酸钙制备流程分析判断,生石膏加热的变化图象,题目难度较大,注意根据图象的质量变化判断可能发生的反应.

 阅读快车系列答案
阅读快车系列答案 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-955kJ•mol-1.
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理.已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(3)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
②根据表中数据,计算T1℃时该反应的平衡常数为0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
④下列各项能作为判断该反应达到平衡的是CD(填序号字母).
A.容器内压强保持不变 B. 2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是减小CO2 的浓度.请在图中画出30min至40min的变化曲线.
(1)氯水久置后会变质,请分析变质的原因.(请用方程式及必要文字说明分析)氯气与水反应:H2O+Cl2?HCl+HClO,HClO不稳定分解:2HClO═2HCl+O2↑
(2)如果增大氯气的压强,氯气在水中的溶解度将增大(填“增大”“减小”或“不变”)
Ⅱ、在2L恒容的密闭容器中,加入4mol SO3(g),在某温度下使其反应,反应至4min时,氧气的浓度为0.5mol/L,当反应到8min时,反应到达平衡.
(1)0min~4min内生成O2的平均速率:v(O2)=0.125mol/(L•min).
(2)若8分钟达到平衡时,测得SO3浓度为0.04mol/L.若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.04mol/L的是BD
| A | B | C | D | |
| SO3 | 0mol | 4mol | 2mol | 0mol |
| SO2 | 4mol | 1.5mol | 0mol | 4mol |
| O2 | 2mol | 0mol | 0mol | 4mol |
| A. | 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 | |
| B. | 降低温度,正反应速率减小,而逆反应速率增大 | |
| C. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980 g | |
| D. | 达到平衡时,SO2的转化率是90% |
| A. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| B. | KI溶液与H2SO4酸化的H2O2溶液混合:2 I-+H2O2+2 H+=2 H2O+I2 | |
| C. | 向NH4HCO3溶液中滴加过量Ba(OH)2溶液:HCO3-+OH-+Ba2+=H2O+BaCO3↓ | |
| D. | 高锰酸钾酸性溶液吸收二氧化硫:SO2+MnO4-+4H+=SO42-+Mn2++2H2O |