题目内容
10.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.可以用下列方法制备ClO2
2NaClO3+H2O2+H2SO4═2ClO2↑+Na2SO4+O2↑+2H2O
被氧化的物质是H2O2,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为2.24L.
分析 化合价升高元素在反应中被氧化;根据化学方程式转移电子的数目以及方程式的系数之间的关系来计算.
解答 解:化合价升高的元素是H2O2中的O元素在反应中被氧化,反应2NaClO3+H2O2+H2SO4═2ClO2↑+O2↑+Na2SO4+2H2O中,有2mol电子转移,则产生的ClO2气体2mol,若反应中有0.1mol电子转移,则产生的ClO2气体0.1mol,在标准状况下的体积为0.1mol×22.4L/mol=2.24L,故答案为:H2O2;2.24.
点评 本题考查学生氧化还原反应中的概念以及化合价升降和电子转移知识,难度中等,注意知识的归纳和梳理是关键.

练习册系列答案
相关题目
20.下列物质中,只含有非极性共价键的是( )
| A. | Na2O2 | B. | I2 | C. | CaCl2 | D. | NaOH |
1.已知A、B、C、D、E是5种短周期元素,C、D、E是原子序数依次递增的同周期元素,A的最外层电子数是其电子层数的3倍,B是组成有机物的必要元素,元素D与B为同族元素,元素C与E形成的化合物CE是厨房常用调味品.下列说法正确的是( )
| A. | 简单离子半径:E>A>C | |
| B. | C和E的单质可通过电解饱和的CE水溶液获得 | |
| C. | C与A形成的两种化合物中化学键类型完全相同 | |
| D. | B、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
18.在t℃时,NaOH的溶解度为20g,该温度下将50gNaOH放入220g水中充分搅拌后,测得溶液密度为1.2g/mL,则溶液的物质的量浓度为( )
| A. | 0.02mol/L | B. | 0.5mol/L | C. | 5mol/L | D. | 5.6 mol/L |
5.将Mg、Cu组成的2.64g混合物投入适量稀硝酸中恰好反应,固体完全溶解时收集到的还原产物NO气体0.896L(标准状况),向反应后的溶液中加入2mol/L的NaOH溶液60mL时金属离子恰好沉淀完全.则形成沉淀质量为( )
| A. | 4.32 g | B. | 4.68 g | C. | 5.36 g | D. | 6.38 g |
15.有关金属性质的叙述正确的是( )
| A. | 常温下都是晶体 | B. | 最外层电子数少于3个的都是金属 | ||
| C. | 都能导电、传热 | D. | 都只能和酸不能和碱发生化学反应 |

 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl;②
+HCl;②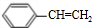 +NaCl+H2O;
+NaCl+H2O; +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2NaBr;⑤2
+2NaBr;⑤2 +2H2O;
+2H2O; +H2$→_{△}^{Ni}$2
+H2$→_{△}^{Ni}$2 ;⑧n
;⑧n +nH2O.
+nH2O.